医疗器械单一体系审核MDSAP认证咨询辅导
通过MDSAP审核将:
• 提供可预测的审核计划(包括审核开始和结束日程)
• 减轻医疗器械制造企业多重法规审核的负担
• 利于患者的健康和了解(*工厂审核的障碍)
• 优化监管资源配置
• 可与ISO 13485和CE符合性审核相结合
• 多国法规要求一次审核完成
美国,澳大利亚,巴西,加拿大,日本五国的监管机构,加入“医疗器械单一审核程序(Medical Device Single Audit Program (MDSAP))”项目并试行。该程序旨在建立一套单一审核的过程,满足并统一上述国家的审核要求,使审核更加*有效。
2015年1月1日,在**范围内,对于美国,澳大利亚,巴西,加拿大市场感兴趣的生产企业受邀参加了该项目。2019年夏天,日本正式成为MDSAP的一员,对于日本市场感兴趣的生产企业也将受到该项邀请。
MDSAP由第三方进行审核,参与国的医疗器械监管部门可以将此审核报告作为判断依据。MDSAP不仅减少了监管部门例行检查的工作,也使得各监督部门共享相同且可靠的审核结果。
由于监管机构认可MDSAP的审核结果,生产企业可以减少对应不同监管机构的审核次数,减少因审核带来的生产干扰。MDSAP的出台,使审核过程国际标准化,减轻了生产企业的负担。MDSAP的审核依照参与国的已有法规要求,不额外增加其他要求,绝大多数情况下,各国的要求采用的是协调标准或标准内容基本类似,例如:医疗器械质量管理体系用于法规的要求(ISO 13485:二016),巴西的良好生产规范(RDC ANVISA 16/2013),美国质量体系规范 (21 CFR Part 820)和MDSAP参与国的其他特定上市前和上市后的法规要求。
接受MDSAP的审核代替FDA的例行检查,每两年对所有类别的医疗器械,包括体外诊断设备进行MDSAP审核,但上市前审核(PMA)和投诉检查不能用MDSAP替代。
通过生产企业的不断参与,MDSAP项目将会逐渐完善,预计将于2019年正式运行。MDSAP将会提升第三方机构的公信力,推动各国法规及审核标准的统一,扩展针对患者保护的***网络。
初始认证审核是针对文件和整体准备情况进行审查,通常包括对规划文件的审查。 认证审核是针对与ISO13485以及参加MDSAP的监管机构的其他规定的QMS合规性进行评估。 监督审核每年进行一次,MDSAP的审核周期为3年,特殊审核、由监管机构执行的审核以及飞行检查属于额外的审核,可能会发生在审核周期内的任一时间。
针对制造商的产品或QMS过程在初始认证审核之后的任何变化进行评定。
重新认证审核针对制造商的质量管理体系在满足MDSAP的QMS要求方面的持续适当性和有效性进行评估。

SUNGO公司介绍
SUNGO GROUP:
SUNGO TECHNICAL SERVICE INC美国公司;
SUNGO Certification Company Limited英国公司
SUNGO Europe B.V.荷兰公司;
SUNGO Cert GmbH德国公司;
SUNGO Australia澳大利亚公司;
上海沙格企业管理咨询有限公司(中国)
上海沙格企业管理咨询有限公司武汉分公司
上海沙格企业管理咨询有限公司广东分公司
SUNGO集团凭借**网络和专业队伍为**客户提供法规性服务,在医疗器械行业尤为专长。
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余国际法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
上海沙格企业管理咨询公司已经在国内近千家客户提供了相关服务,也受美国几家大型采购集团委托,对其在中国的供应商进行二方审核工作,我们的客户集中在无纺布行业企业、敷料耗材、病床、轮椅、体外诊断医疗器械行业、大型饲料机械设备企业、电子电器行业类别。公司一直秉承“专业辅导、增值服务、国际品质、本土价格”的方针,为客户提供优质的服务。
我们服务过的部分**企业及上市公司有:
新华医疗、鱼跃医疗、威高集团、阳普医疗、艾迪尔医疗、驼人医疗、恒安集团、康德莱集团、阿蓓纳、上海联影、上海复旦医疗、微创骨科医疗、普罗医学、凯利泰、联医医疗、羚锐制药、江西3L、正昌集团、杭州可靠、台钜集团、维达集团、青岛光电、科勒、暴龙眼镜等等
医疗器械单一体系审核MDSAP认证咨询辅导
一、医疗器械单一审核(MDSAP)总体目标与项目背景,:
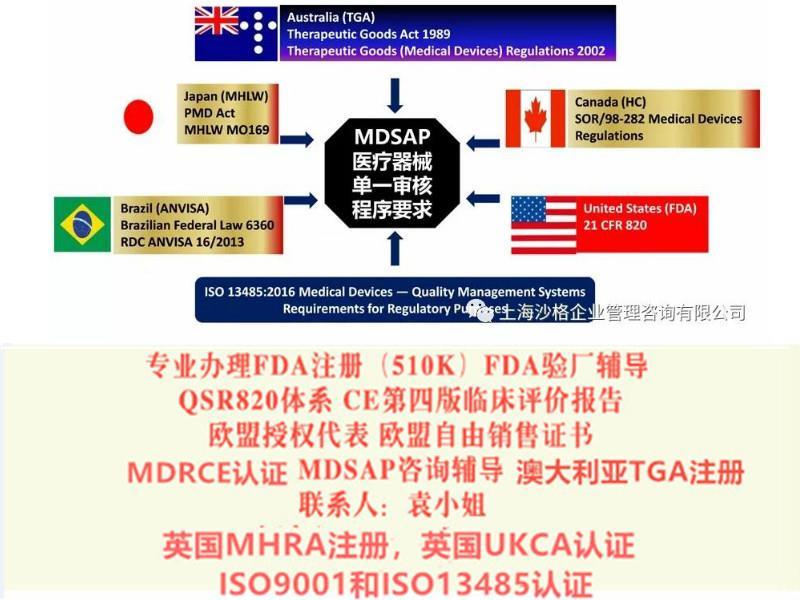
医疗器械单一审核(MDSAP)旨在通过单一质量管理体系(QMS)审核使制造商满足参与国的QMS要求。该程序由国际医疗器械监管者论坛(IMDRF)以及以下目前参与IMDRF的监管机构共同创建:美国食品和药物管理局(FDA)、加拿大卫生部、澳大利亚药物管理局(TGA)、日本医药与医疗器械局(PMDA)以及巴西国家卫生监督局(ANVISA)。
二、国际医疗器械监管机构论坛:IMDRF取代GHTF,IMDRF国际医疗器械监管机构论坛管理**成员:
1、US Food and Drug Administration (FDA)美国
2、Health Canada Medical Devices Bureau加拿大
3、Brazilian Health Surveillance Agency (ANVISA)巴西
4、Australia Therapeutic Goods Administration (TGA)澳大利亚
5、European Commission Directorate General Health and Consumers欧盟
6、Japan Pharmaceuticals and Medical Devices Agency (PMDA)日本
7、China Food and Drug Administration中国
8、Russian Ministry of Health俄罗斯
WHY
根据加拿大卫生局已宣告的MDSAP过渡计划,CMDCAS证书(我司现有的ISO 13485证书)在2019年12月31日后将不被接受。为了继续持有现存的医疗器械许可证,制造商将在2019年1月1日前被要求提交有效的MDSAP质量管理体系证书。MDSAP加拿大过渡计划:加拿大卫生局打算将MDSAP实施列为制造商证明其符合质量管理体系要求的一途径。MDSAP于2019年1月1日开始实施过渡,过渡期两年。在这两年内,加拿大卫生局同时接受CMDCAS和MDSAP证书。2019年1月1日起,加拿大卫生局只接受MDSAP证书,CMDCAS质量管理体系证书需要被MDSAP质量管理体系证书替代
WHAT
医疗器械单一审核程序”(Medical Device Single Audit Program (MDSAP) )项目是美国(FDA)、澳大利亚(TGA)、巴西(ANVISA)、加拿大(HC)、日本(MHLW)五国的监管机构认可并加入的一套新的审核程序。该程序旨在建立一套单一审核的过程,满足并统一上述国家的审核要求,使审核更加*有效。以上五国监管机构认可MDSAP的审核结果,生产企业可以减少对应不同监管机构的审核次数,减少因审核带来的生产干扰。MDSAP的出台,使审核过程国际标准化,减轻了生产企业的负担。ISO13485与MDSAP的对比:ISO13485是MDSAP的基础;MDSAP的要求要**/多于ISO13485的要求;ISO13485是标准,MDSAP除了ISO13485之外,还有各参与国的法规要求;两种认证,核心都是质量管理体系。
● 医疗器械行业从业16年经验,医疗器械法规、体系咨询师
● 精通医疗器械CFDA,FDA,CE法规
● 熟练掌握ISO13485/YYT 0287, ISO14971/YYT 0316, QSR820, JGMP, GMP 质量体系等
● 擅长美国FDA QSR820医疗器械辅导,熟练掌握QSR820各难点子系统的要求
● 具有几十家医疗器械企业咨询辅导成功经验和案例,帮助企业*美国FDA QSR820的审核,并部分企业获得零缺陷通过;并辅导企业获得ISO13485证书及CE证书,CMDCAS证书等。主要辅导的企业包括:新华医疗,怡和嘉业,河北普康等
●对于美国法规有经验丰富的专业团队,能够及时高效的提供服务。目前我们是国内一一家成功提供了FDA警告信解除和黑名单移除辅导的咨询机构
我们的服务:
协助您按照MDSAP建立质量体系
协助您在原有的质量体系上符合MDSAP的要求
整合您的质量体系,满足各国法规的要求
培训服务

ISO13485&和MDSAP与风险管理的背景和趋势
http://sungofda.cn.b2b168.com