手动病床的SUNGOCE认证-需要什么材料
更新时间:2025-02-27 浏览数:131
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:¥123.00 元/个 起
周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
sungo可以办理加拿大的MDEL注册
欧盟授权代表
对于在欧盟市场流通的产品,为了实现产品的可追溯性以及便于和保护欧盟消费者等目的,欧盟在某些特定指令中要求欧洲经济区以外国家的制造商必须欧盟授权代表(European Authorised Representative,简称EAR)履行欧盟相关的指令和法律对该制造商所要求的特定的职责。简言之,欧盟对高风险领域(器械)实施了设立欧盟授权代表要求,是便于直接,落实责任而制定的法律要求。

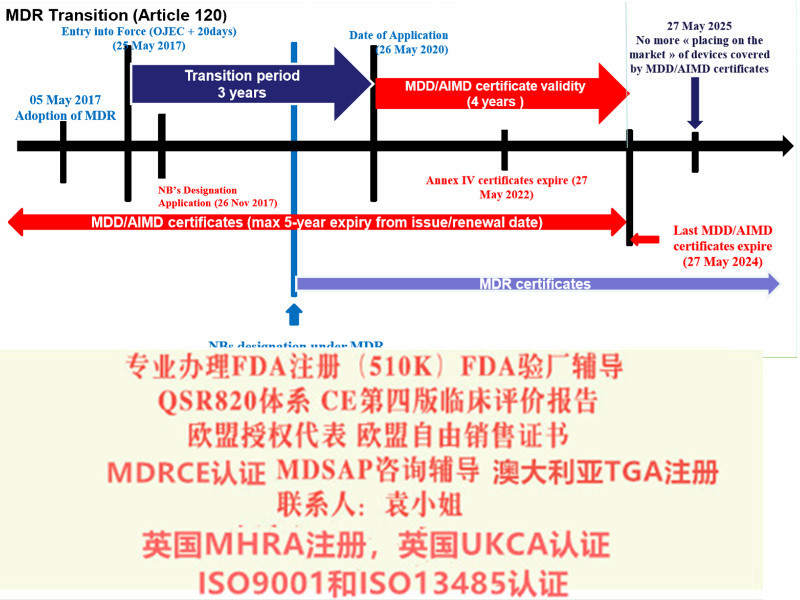
欧盟会规定了MDR 的转换期的要求
2017 年5 月25 日:MDR 和IVDR 生效
2020 年3 月25 日:启动欧盟器械数据库(Eudamed)
2020 年5 月25 日:MDR 实施开始
2022 年5 月25 日:IVDR 实施开始
2024 年5 月25 日:AIMD,MDD 和IVDD 证将失效
CE技术文件
2017年2月Regulation (EU) 2017/745 on Medical Devices器械法规(MDR)提案发布,同年3月,欧盟成员国一致表决同意MDR。2017年5月5日,欧盟Official Journal正式对外宣MDR法规内容。MDR新法规将取代现行的有源器械指令Council Directive 90/385/EEC on Active Implantable Medical Devices (AIMDD) (1990)以及器械Council Directive 93/42/EEC on Medical Devices (MDD) (1993)指令。原计划2020年5月26日正式实施的MDR受**影响将推迟实施时间至2021年5月26日。
在此期间,仍然可以进行以下MDD的相关活动,例如产品变更及一年期内MDD新户的申请;现有MDD客户更新的相关活动;现有MDD客户更新的申请(包括提前更新的申请);现有MDD客户重大变更的申请期。虽然MDR的正式实施有延期,但是有例外情况如:
· MDD产品的投放截止日期仍为2024年5月26日
· MDD产品供应截止日期仍为2025年5月26日。

f) 由CMDCAS认可机构颁发的MDSAP体系证。
SUNGO致力于为**的器械生产商和经营者提供市场准入的合规咨询以及国际注册服务。从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。十多年里,SUNGO已为**30多家上市公司和**器械制造商,合计5000多家企业提供过相关服务。
SUNGO始终追求支持、服务和客户满意。
http://sungofda.cn.b2b168.com