鞋套的MDR CEMDR CE EU 2017-745认证 eac认证 完整版
更新时间:2025-02-27 浏览数:13
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
在法规事务或与器械有关的质量管理体系方面有四年的经验。
出口英国需要办理UKCA认证:随着2020 年12 月31 日英国脱欧过渡期结束,2021 年1 月1 日期英国企业器械产品在英国上市,要求符合UKCA 要求。

给企业一些建议: •要求的大幅增加对制造商(特别是中小企业)产生了巨大影响 •增加人才**性:制造商,机构,组,欧盟授权代表等需要熟悉法规,技术和人员 •尽早开始准备! •检查产品分类和合规途径是否受到影响! •内部自我检查,以确保技术文件:符合的技术要求;特别是评估!满足语言要求 •了解MDR和内部差距分析的变化 •选择一个稳定,成熟的公告机构!
产品注册 制造商在器械投放市场前,应在Eudamed进行注册,提交企业信息及器械信息,包括器械的UDI信息,取得单一注册号(SRN)。

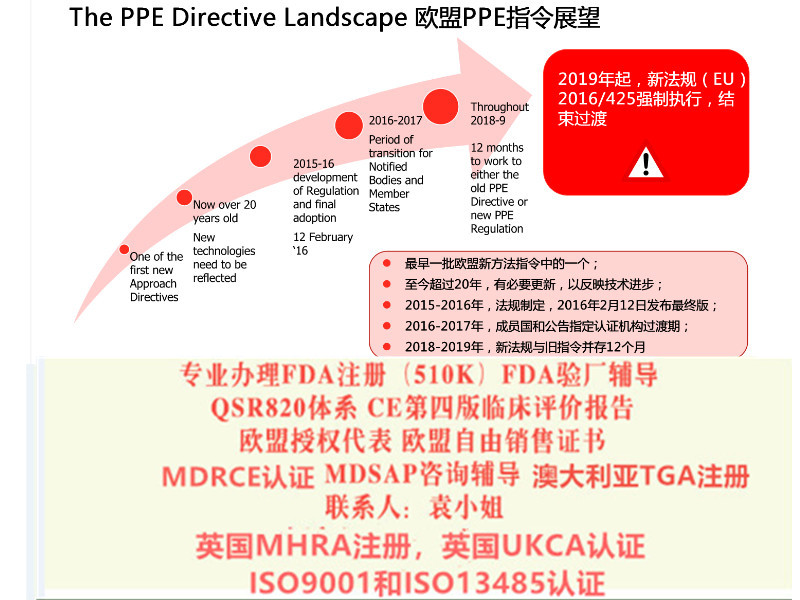
仅具有根据90/385/EEC 和93/42/EEC 指令签发的的器械可投放市场的前提是自MDR 适用之日起,其在设计和预期目的上无显著变化并符合新法规有关市场后监察、市场监察、警戒、经济运营商及器械注册的规定。
我公司办理: 出口英国需要UKCA认证,英国代表,MHRA注册
http://sungofda.cn.b2b168.com









