一次性使用医用口罩的MDR CEEU 2017-745认 EU 2017-745认 完整版
更新时间:2025-04-12 浏览数:
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
MDR欧盟授权代表和MDD欧盟授权代表的区别: 欧盟授权代表(AR)是指在欧盟境内的任何自然人或法人,其收到并接受位于欧盟以外的制造商的书面授权,代表该制造商按照本法规对制造商所规定的义务要求所进行的一切行动。
主要变化之二:报告编写人和评价人的 按照新版报告指南的要求,对于报告的编写人提出了要求。包括需要有相关的高等教育学位以及至少五年的经历,或者十年的工作经历,如果学位不够的话。如果不能满足要求,需要对其进行判定和说明。

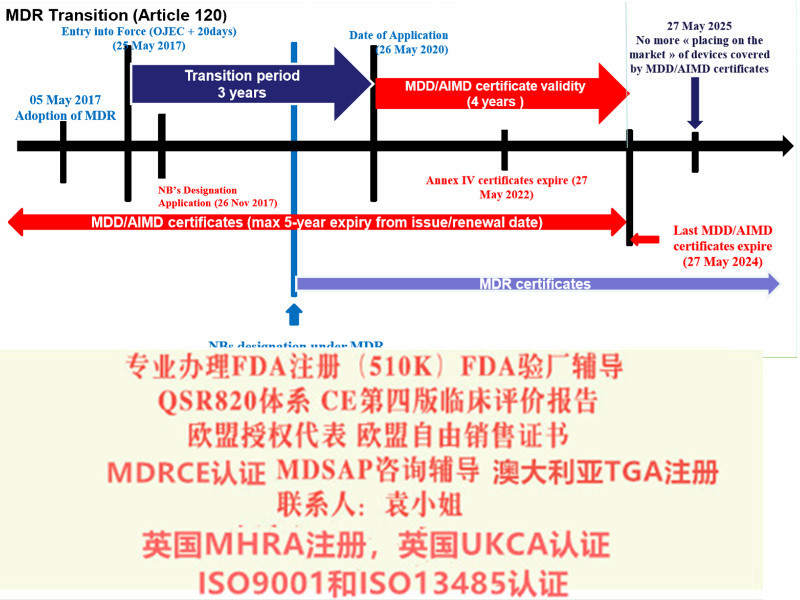
从法律条文来讲,2017年5月5号在欧盟发布,5月25号正式生效,当中还存在3年的过渡期,三年过渡期里面,MDD指令还是有效的,也是说厂家在这三年有效期内,还是可以根据MDD指令来申请MDD书,但是现在很多公告机构已经不接受MDD的申请了。

英国授权代表UK Responsible Person是什么? 器械英国MHRA注册简介 英国脱欧后,按照脱欧协议,将陆续不再认可欧盟CE认,对于器械,CE认在英国可继续使用至2023年6月30日,但需要持有CE认的企业在英国当地有英国负责人(类似欧盟授权代表),由英国负责人进行MHRA注册,才能进入英国GB地区市场(英格兰,威尔士和苏格兰)。2023年7月1日起,不再认可CE认,必须进行UKCA认。 MHRA=Medicines and Healthcare products Regulatory Agency 英国药品和产品当局
按照附录VIII的规则所划分的器械风险等级 当前声明所涵盖的器械符合本法规,以及适用时其他相关的要求签署欧盟符合性声明的欧盟立法的声明 符合性声明中所用的任何通用规范的索引公告机构的名称和标识号(如适用),所执行的符合性评估程序的说明和所签发的书的标识 如适用,额外的信息 签字人的声明,地址和日期、签字人姓名和职务、以及代签人签名
我公司办理:出口美国需要FDA注册,FDA510K,美国代理人(SUNGO可以做510K以及满足FDA要求的510K检测报告,7月份签约价格有优惠)
http://sungofda.cn.b2b168.com