一次性输尿管导管EC REP认证 SUNGO的瑞代 EC REP怎么申请
更新时间:2024-06-29 浏览数:13
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
我们的核心资源包括分布在**主要经济体的运营网络,具有美国IAS认可资质的实验室,具有ANAB认可资质的认证机构,以及分布**的资源。
式中: m——线的斜率。 详细说明参见作业书或EN 455-4标准。 2. 阀值确定 EN455-1、EN455-2初始性能测试包含力学性能测试与水密性测试。其中断裂力测试值指标作为老化后阀值依据。例如,检测某批次丁腈手套平均断裂力为8N,而EN455-2要求的丁腈手套断裂力值为6N,那么阀值为初始断裂力的75%(6N/8N*) 3. 达到阀值所需时间的测试与计算 3.1老化时间点规划 分别选取3批次手套,选定5个温度点,分别是90℃、80℃、70℃、60℃、50℃。其中90℃、80℃老化实验时间为5天、20天,实际达到阀值的时间预估为3天以内。然后以这两个温度点推算50℃、60℃、70℃预计达到阀值的时间,设计样品取出测试时间点

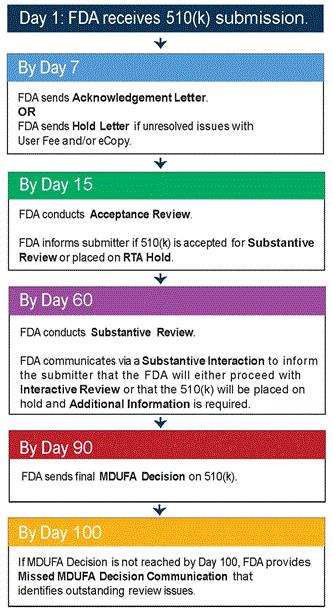
什么是510(k) FDA510(k)即上市前通告PMN(Pre-market Notification),旨在该产品与已经合法上市的产品实质性等同(Substantially Equivalent)。因其描述在食品、药品和化妆品法案(FD&C Act)的第510(k),故通常称作510(k)。大部分的II类器械,以及少量的I类和III类器械在上市前都需要向FDA提交510(k)申请。

说到这里 企业应该如何面对新法规的升级呢?按照MDR法规要求。关键的内容包括如下几个方面: 企业的质量管理体系 EN ISO13485:2016 ,产品的型式试验 TYPE TESTING , 产品的技术文件 TECHNICAL CONSTRUCTION FILES要满足这些要求,通常需要咨询机构和咨询师的协助。本公司拥有一支经验丰富的咨询师队伍可以为贵司提供这些服务,包括: 协助贵司建立/升级器械质量管理体系,将MDR法规的内容整合进去 协助贵司确定产品的欧盟协调标准,确认检测实验室的,样品准备以及检测不合格整改的研讨 按照MDR要求协助贵司准备技术文件,包括风险分析报告,评估资料,基本要求检查表等 协助贵司按照欧盟的要求修订说明书和标签,使其满足出口的要求。
主要变化之六:比对器械 第四版评估指南对于评估器械和比对器械的等效有了更加详细的规定,特别强调对于比对器械的数据的可获得性。需要从数据、技术参数、生物性能三个方面逐一比对,确保所有比对的内容不存在差异。
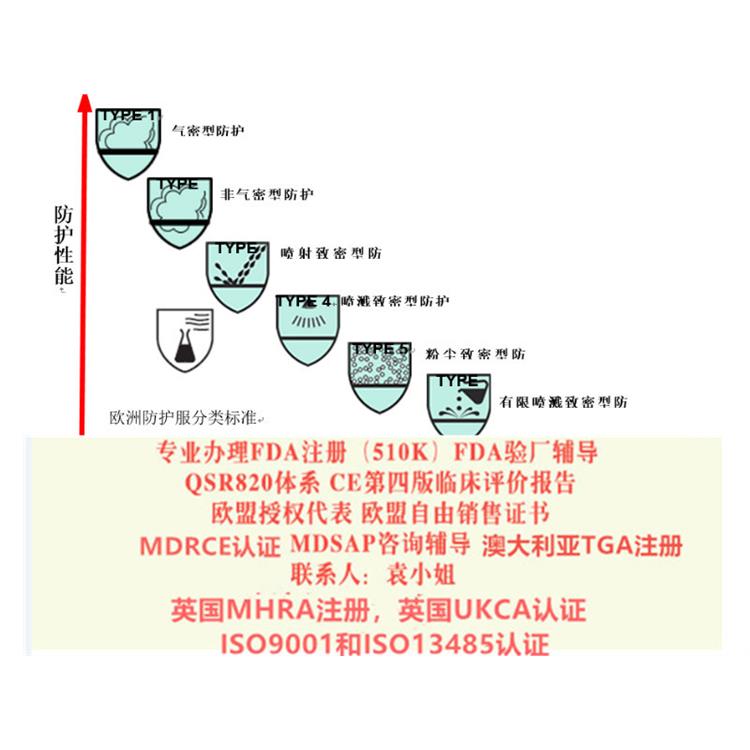
个人防护类防护服:非医用防护服可以按照个人防护用品出口到欧盟,需要满足(EU)2016/425(PPE)指令。PPE将个人防护产品分为I类、II类、III类产品。
http://sungofda.cn.b2b168.com