护腕欧盟授权代表 SUNGO的瑞士代表注册 英代是什么
更新时间:2024-07-03 浏览数:2
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
手术衣510K,隔离衣510K,手套510K,电动/手动轮椅510K,FDA注册,FDA美国代理人
上市后(PMS) (MDR第83~86条) PMS需收集、记录并分析器械在其整个生命周期内的质量、性能和相关数据,以得出必要的结论,并确定、实施和监测任何预防及纠正措施。 I类器械制造商应编制一份上市后报告,总结根据上市后计划收集的数据分析结果和结论,以及采取的任何预防和纠正措施的理由和说明。必要时应更新报告,并应主管机构的要求提供。 IIa、IIb和III类器械制造商应针对各器械或类别或器械组编制定期性更新报告(PSUR),总结根据上市后计划收集的数据分析结果和结论,并对采取的任何预防和纠正措施提供理由和说明。
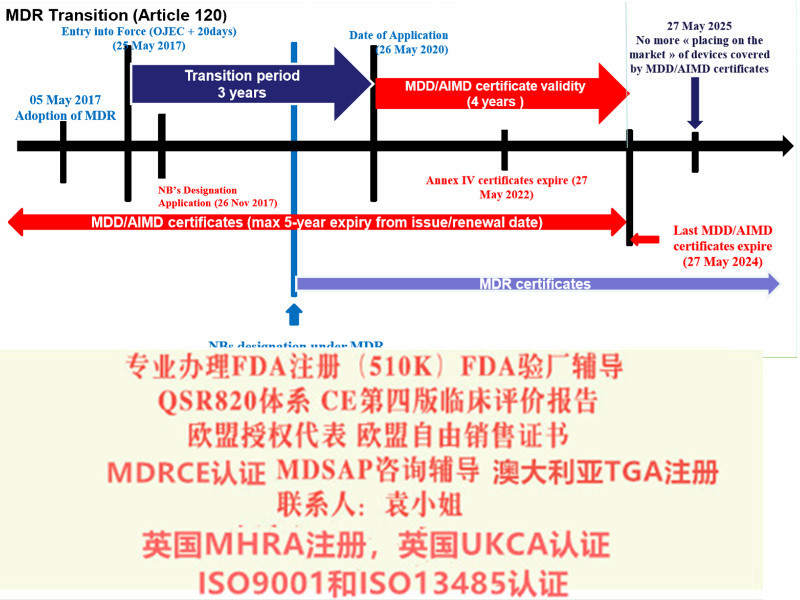
通过豁免指令的形式上市,且符合新法规的器械可在2020 年5 月26 日之前投放市场。并可在2020 年5 月26 日前并通知符合新法规的符合性评估机构。公告机构可在2020 年5 月26 日前, 采用合规的符合性评估流程并按照新法规签发。

我公司是做: 1:新MDR法规和MDD指令的欧盟CE认证,CE第四版评价报告更新/编写 2:欧盟自由销售证书,欧盟授权代表(德国,荷兰,英国), 3:ISO9001/ISO13485认证以及咨询 4:FDA注册,FDA510K,FDA验厂/陪审和翻译 5:MDSAP咨询,国内注册证,生产许可证的办理

我们该怎么办?
l 重新确认产品风险分类等级,确认是否有风险等级升级的情况?
例如部分可重复使用的器械,原属于ClassⅠ的器械,按照新法规变成了ClassⅠ*类器械。美容类产品原MDD下不属于范围,现MDR法规中已纳入;
l 确认原CE证的发证机构是否已获得欧盟当局批准的颁发MDR证的,目前拥有该的认证机构:BSI、TUV南德(注意TUV莱茵目前还未获得批准);
l 确认原CE认证时的技术文件中是否含有按照Rev4原则提供的评价报告;
l 确定企业合规负责人(MDR法规要求),有相应能力、和经验来承担相应的法规工作职责。
l 修改原CE技术文件,建立质量管理体系,向具有MDR发证的认证机构提出MDR-CE认证申请,获得MDR法规下的新CE证。
上海沙格有着的咨询师团队,丰富的案例经验。
http://sungofda.cn.b2b168.com









