尿液分析仪MDR的CE第四版临床评价报告 临床检测报告 申请条件
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
品牌SUNGO
公司SUNGO
流程SUNGO
国家欧洲
评估及更新质量管理体系(以下第3点) 检查可用证据和风险管理的充分性,识别差异(第56条) 评估产品标签(附件I第Il1章) 确保上市后监督的安排充分适宜够(第七章第1节) 制定上市后性能跟踪(PMCF,附件XIV B部分) 做好迎接新的警戒需求的规定(第七章第二节) 确保可追溯相关方面的义务(第3章) 3,质量体系评估 评估新IVDR法规下QMS符合标准和流程的程度 增加新法规应用于QMS的要求 协助和识别合规负责人(PPRC)并参与培训 4,公告机构NB确认 选择合适的公告机构,确认公告机构资质及范围
上市后(PMS) (MDR第83~86条) PMS需收集、记录并分析器械在其整个生命周期内的质量、性能和相关数据,以得出必要的结论,并确定、实施和监测任何预防及纠正措施。
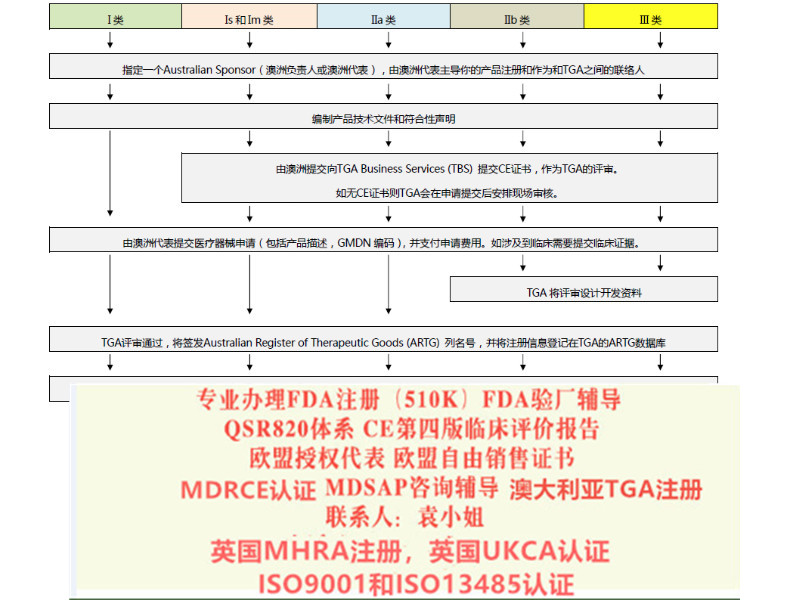
TUV/***/BSI等公告机构要求的欧盟第四版器械评价/评估报告,提供编写或更新。

湿热验证ISO 17665-1、ASTM ST79 清洁、和确认方案和报告 对于可重复使用器械,在使用后如何进行清洁和/关系到器械的适用。 采用何种方式的清洁,/能够确保产品达到重复使用的条件需要通过系列实验来完成。

CE第四版评价报告MEDDEV 2.7.1 Rev4难点:
1. 满足要求的比对器械;
2. 筛选文献、评估文献;
3. 应用的背景;
4. 产品的优势
瑞士也已经不认可欧洲的CE认证,您有产品出口瑞士吗?是否有做瑞士代表以及瑞士注册的?
http://sungofda.cn.b2b168.com









