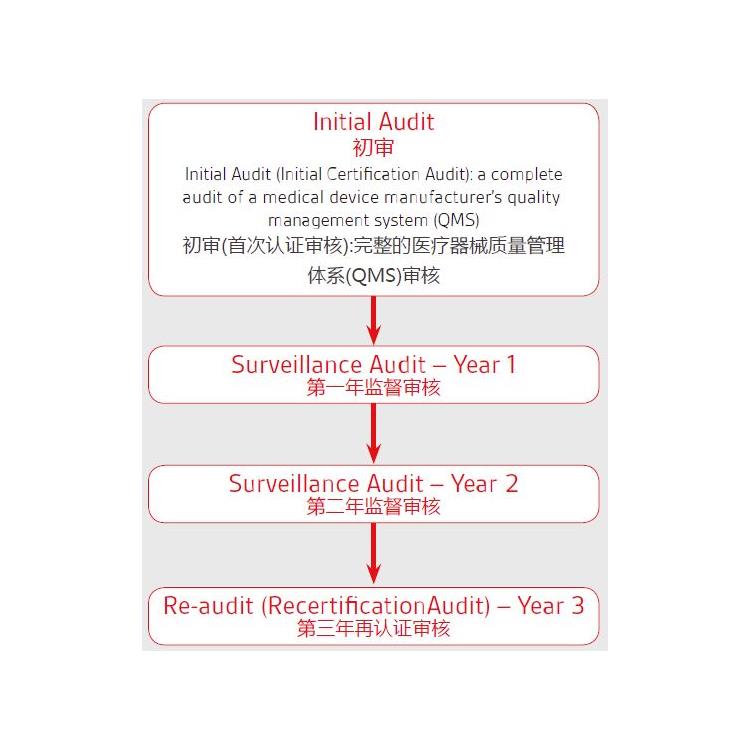
颈托的MDR-CE认证 的流程及步骤
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
法规条款增加,认证评审更加严格, 引入了器械标识UDI,增加产品的可追溯性;
主要变化之三:评价报告需要有明确的可测量的目标
第四版评估指南对于评估报告的目的有更明确的描述,需要与器械的性、性能以及风险-收益平衡进行更加清晰和详细的描述,在指南的第7部分和附件5中有详细的描述。(袁 ()
主要变化之四:确定技术发展水平
第四版评估指南对于设备的技术发展水平和处理方式的建立和文件化,提供了更加详细的描述。这包括确定设备的性和性能,以及被宣称的比对器械,行业的基准器械,或者其他的类似器械;需要包括风险和收益的分析。

基于本版法规的器械将很大程度上提高欧盟对器械产品的要求,不论是制造商还是公告机构都将面临更严格的管理,基于目前的产品分类规则,更多的产品将需要执行公告机构参与的符合性评估流程,更多的品种纳入了器械。

法规先规定了制造商的义务,涵盖生产、合规、上市后的产品全生命周期,但法规同时规定,经销商、进口商或其他自然人或法人在向市场提供以其名字、注册商标命名的器械时应承担制造商相应的义务,也包括变更相应器械预期用途或变更其他影响其符合性的事项的情况。在上市后要求中,经济运营商同时负有相应的责任和义务。

法规条款增加,认证评审更加严格
a. 分类规则增加:由MDD的18条增加到 22条;
b. 基本要求检查表条目增加:由MDD的13条增加到 MDR的23条;
c. CE技术文件的结构发生了变化,分为:产品技术文件和上市后文件(MDD只要求产品技术文件);
d.评价报告。MDR要求企业提供第四版评估报告,相比于第三版,第四版要求更为严格;
5:MDR要求更高的透明度和可追溯性
a. 引入了器械标识UDI,增加产品的可追溯性;
b. 企业的相关信息都会被收集到欧洲器械数据库(EUDAMED);
c. 建立上市后监督(PMS)系统;
我公司办理: 出口英国需要UKCA认证,英国代表,MHRA注册
http://sungofda.cn.b2b168.com