周期4周
品牌SUNGO
公司SUNGO
流程SUNGO
国家欧洲
从公告机构处获得CE证书和ISO 13485证书。
对于公开文献的数据搜集,国内的生产商还有一个常见的错误,即没有预先建立一个搜索的策略,该策略必须囊括所有适用的数据(无论是正面的还是的),而不是选取仅仅是“好的”文献。在第四版的要求中,仅仅获得数据是没有用的,还需要“运用”这些数据来申请产品的性和有效性。“运用”包括:
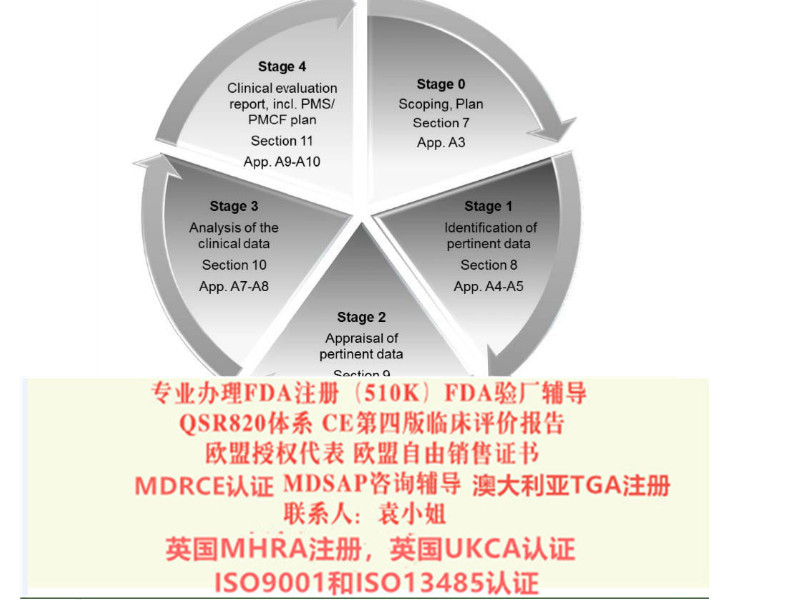
CE第四版(MEDDEV2.7.1Rev4)报告
评价要进行的是现行有效技术(StateoftheArt)的评估
评价分析器械/等同器械的数据,包括:
的要求(ER1);
风险收益比的要求(ER3);
性能的要求(ER3);
的可接受度(ER6);
以及决定是否需要进行上市后的跟踪;
CE第四版(MEDDEV2.7.1Rev4)报告
在分析的过程中,第四版更注重引入“统计分析”的方法,包括:
数据评估和加权(第9节和附录6)
数据分析和证实符合性(第10节和附录7)
第四版的原则还对“”提出了明确的要求,包括资质要求以及“利益声明”的要求。资质要求每一个评审人员具有高等*以及5年的工作经历(或不具备高等*时,10年工作经历)。工作经历并不单纯的指的经历。常见的模式是评价由生产商的产品准备,因为没有人比生产商自己更了解他们的产品,那么对于产品来说,其工作经历应当是与改产品研发相关的经历。此外,评价报告应当由进行审核,那么对于来说,需要有相关的工作经历,而且其工作经历应该确保其熟悉该产品的适用。
CE第四版(MEDDEV2.7.1Rev4)报告
按照第四版原则的要求,评价报告应当包含以下内容:
(一)概要
(二)评价的范围
(三)评价的背景:当前的知识,新的技术水平
(四)评价的设备
4.1评价的类型
4.2等同性说明
4.3制造商产生和持有的数据
4.4来自于文件的数据
4.5数据的总结和审核
4.6数据的分析
(五)结论
(六)下次评价的日期
(七)日期和签名
(八)负责评价的评价者的资质
(九)参考
评价报告还应当确定并论证定期更新的频率:
如果有严重风险或者没有良好的建立风险,则至少每年1次
如果没有严重风险并且已经良好地建立了风险,则2-5年一次
当上市后数据显示对现有的评价有影响时需要主动更新!
CE第四版(MEDDEV2.7.1Rev4)报告
对于生产商的一些建议
1.相比于第三版,第四版给予了更多的指南,生产商应从中考虑问题力求评估文件完整性和科学性。
2.生产商应关注第四版相比与第三版的差,使评估文件符合新法规的要求。
3.生产商除了关注CE相关法规外,也应关注本国和其他拟出口的评估要求。随着食品品监督和CE以及FDA法规当局的沟通利益密切,可以看出监局的评估指南,对于CE的评估指南有一定的参考和借鉴意义。
4.生产商应将评估程序纳入质量体系,并应综合考虑拟销售的相关试验/评估的法规要求。
关于MEDDEV2.7.1Rev4,SUNGO可以协助您:
1、协助建立评价程序;
2、建立评价方案
3、寻找等同产品,进行等同分析;
4、搜索文献及其他数据;
5、数据分析;
6、完成评价报告。
我公司是做: 1:新MDR法规和MDD指令的欧盟CE认证,CE第四版评价报告更新/编写 2:欧盟自由销售证书,欧盟授权代表(德国,荷兰,英国), 3:ISO9001/ISO13485认证以及咨询 4:FDA注册,FDA510K,FDA验厂/陪审和翻译 5:MDSAP咨询,国内注册证,生产许可证的办理

类似于质量授权人注意到新法规主要在以下几点上发生了变化:1.器械的定义;2.器械的分类;3.基本和性能要求;4.技术文件要求;5.评价;6.上市后;7.Eudamed数据库;8.对NB公告机构的要求(新法规生效后NB将按照新的要求重新进行授权);9.对高风险器械的新增了要求;总的说来新的MDR和IVDR加强了体系管理,对高风险设备增加了相关规定比如对于非用途但具有与器械相似特性的设备也将受到新法规的管辖(如用于美容的彩色眼镜),提升了产品对患者的透明度和可追溯性并设立电子数据库(Eudamed)、设备将有一个的识别号这加强其在整个供应链的可追溯性。

MHRA注册期限 UK:英格兰、威尔士、苏格兰、北爱尔兰; GB:英格兰、威尔士、苏格兰
SUNGO依靠这些资源,我们为**的器械生产商和经营者提品全生命周期的市场准入服务。
http://sungofda.cn.b2b168.com









