产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
随着MDR(EU 2017/745)法规的实施,欧盟市场对器械的要求越来越高。对于出口量较大的防疫物资——防护服、隔离衣、手术衣,企业有必要了解下各产品出口欧盟需遵循的合规程序。
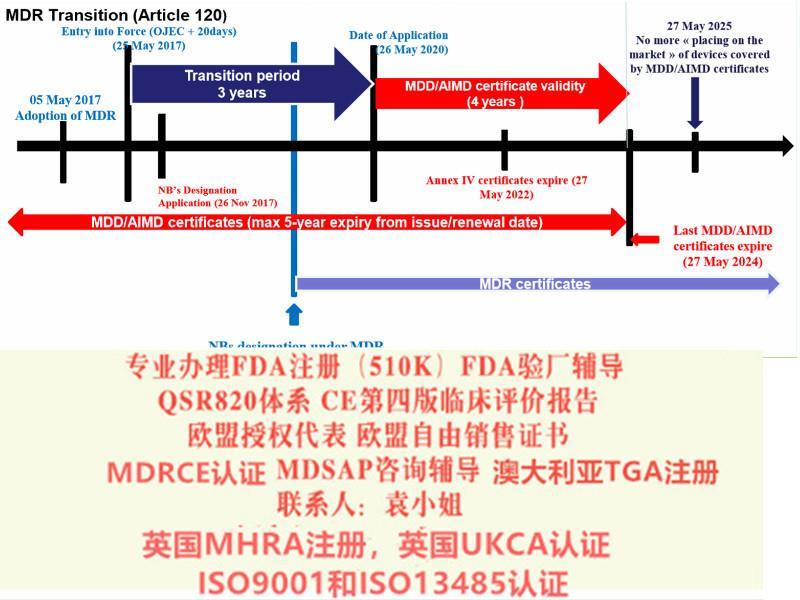
看下以下这张表格可以说是一目了然的,虽然2020年05月26号MDR强制实施,并不意味着2020年05月26号之后,按照原93/42/EEC指令颁布的MDD证书失效,但是所有按照原93/42/EEC指令颁布的MDD证书将会于2024年05月27日失效,所以2024年05月27日是一个截止日期。

湿热验证ISO 17665-1、ASTM ST79
清洁、和确认方案和报告
对于可重复使用器械,在使用后如何进行清洁和/关系到器械的适用。
采用何种方式的清洁,/能够确保产品达到重复使用的条件需要通过系列实验来完成。
欧盟主管部门按产品的危险程度,将产品分为:Ⅰ类、Is(),Im(测量),Ⅱa类、Ⅱb类、Ⅲ类
关于I类产品申请CE认证(CE认证的新法规是:2017/745 MDR新法规)的流程如下:
1:那么I类申请CE的流程是 :
企业自己必须确保自己的产品符合欧盟法规,产品是有效的,并建立相关技术文件,签署符合性声明,确定欧盟授权代表(我们提供的欧代是荷兰公司),然后到成员国主管当局注册登记(到荷兰局CIBG注册登记)获得注册信函之后,即可在产品加贴CE标志进入欧盟销售。
不需要TUV,BSI等这些Notified Body公告机构参与审核发证书的
2:SUNGO提供的欧盟授权代表的职责的,不是Notified body公告机构,*到欧盟授权网站查询
3:终给企业的文件是:MDRCE技术文件+MDR 符合性声明+欧盟注册信函

UKCA合格评定的机构
UKCA合格评定机构需要获得英国相关部门的授权。原位于英国的欧盟公告机构,具备MDD/IVDD/AIMDD范围的,可以自动转换成同等范围内的UKCA合格评定机构。需要关注的是UKCA必须是位于英国的机构,因此位于欧盟其他成员国的公告机构,除非其有注册地址在英国并且由该地址持有公告机构,否则将不能开展UKCA认证。
UKCA合格评定的路径
对于器械和体外诊断器械,合格评定路径与之前的MDD和IVDD类似。低风险产品依然可以做自我符合性声明,中高风险则需要UKCA的合格评定机构参与评定。
选择SUNGO,不是选择了一次性的合作伙伴 因为,所以放心!
http://sungofda.cn.b2b168.com