新版MDR(REGULATIONEU2019/745)法规

我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,SGS等CE认证,全套CE技术文件编订, CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
SUNGO的优势
SUNGO Technical Service Inc.在美国负责FDA美国FDA的业务运营。业务范围覆盖到所有的医疗器械产品、食品。提供的服务包括企业注册、产品列名、QSR820审厂辅导、审厂陪同、翻译、510K文件编撰、不符合整改、警告信应对、RED LIST移除等全项目的服务。
SUNGO Certification Company Limited在英国负责MHRA的业务的运营。SUNGO 英国公司按照欧盟相关指令、法规和指南的要求提供欧盟授权代表服务,协助境外制造商处理欧盟境内市场问题。同时获得MHRA授权开展MHRA产品注册和CFS,欧盟自由销售证的业务。截至目前,SUNGO已经为数百家客户提供了欧代服务,其中MHRA注册的客户近百家,CFS的客户增长也非常*。
SUNGO 中国致力于市场运营和客户服务,拥有行业内**的专业团队,同时与国际**认证机构例如TUV莱茵,SUD, SGS, BSI, DNV,劳氏等机构保持良好合作关系。同时在国内医疗器械法规的合规服务中,提供*的辅导和技术支持。
SUNGO的*老师也是IECQ国际电工**标准制定组成员,参与电子电气行业国际标准制定。
SUNGO 专注于欧盟境外企业产品进口到欧盟、美国境内的符合性解决方案,特别是医疗器械、机电和环保领域的法规研究和应对,成功为**近千家企业提供了相关的技术服务和咨询,确保了其贸易的顺利开展。
SUNGO可提供的服务
美国法规:美国代理人、FDA医疗器械企业注册、FDA医疗器械产品列名、FDA食品企业注册、FDA食品接触物质检测认证、医疗器械510K申报、医疗器械QSR820验厂、FDA验厂辅导及整改、FDA警告信应对、RED LIST REMOVAL。
欧洲法规:欧盟授权代表、MHRA医疗器械注册、CFS 自由销售证、MDD 93/42/EEC 技术文件辅导、IVDD 98/79/EC 技术文件辅导、EN ISO13485:2012导入、灭菌验证方案设计和报告编制、GMPC/GMP 认证辅导、净化车间设计及整改、医疗器械欧标检测。
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
其余国际法规:俄罗斯医疗器械注册、俄罗斯CU‐TR认证、印度医疗器械注册、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证。
上海沙格企业管理咨询公司已经在国内近千家客户提供了相关服务,也受美国几家大型采购集团委托,对其在中国的供应商进行二方审核工作,我们的客户集中在无纺布行业企业、敷料耗材、病床、轮椅、体外诊断医疗器械行业、大型饲料机械设备企业、电子电器行业类别。公司一直秉承“专业辅导、增值服务、国际品质、本土价格”的方针,为客户提供优质的服务。
我们服务过的部分**企业及上市公司有:
新华医疗、威高集团、驼人医疗、百润(中国)
我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,SGS等CE认证,全套CE技术文件编订, CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
ce第四版临床评价报告
CE第四版临床评价,随着MEDDEV 2.7.1第四版的出台且没有新旧版本的过渡期,符合制造商大利益的做法便是从现在开始与公告机构讨论如何开始实施这些新要求并从现在开始执行差距评估和资源需求评估。CE第四版临床评价,差距评估已迫在眉睫,因为制造商需要尽快为额外的临床数据进行预算。因此,如果临床试验需要在2019年启动的话,则需要将评估成本记入明年的预算计划内。
CE第四版临床评价,关于MEDDEV2.7.1 Rev 4,我司可以协助您:
1、协助建立临床评价程序;
2、建立临床评价方案
3、寻找等同产品,进行等同分析;
4、搜索文献及其他临床数据;
5、临床数据分析;
6、完成临床评价报告。
CE第四版临床评价,我司可办CE技术文件的整改,CE技术文件的编订,风险管理报告的编写,依据MEDDEV2.7.1Rev4编写的临床评估报告,欧盟代表服务,自由销售certificateCFS,美国FDA注册,FDA验厂辅导等。CE第四版临床评价,报告编写人和评价人的资质 按照新版临床报告指南的要求,对于临床报告的编写人提出了资质要求。包括需要有相关专业的高等教育学位以及至少五年的专业经历,或者十年的专业工作经历,如果学位不够的话。如果不能满足要求,需要对其资质进行判定和说明。
CE第四版临床评价,临床报告更新的频率 按照新版临床报告指南的要求,对于高风险或者新设备,应每年更新;对于低风险的设备,每2-5年更新。CE第四版临床评价,对于如何确定更新的额频率需要有定义。对于任何风险类别的器械,如果从PMS收集到的信息影响到评价或者结论,CER需要进行更新。

我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,SGS等CE认证,全套CE技术文件编订, CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:2016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)
NB应满足的要求-Annex VII
• MDR对NB的要求更加严格
• NB的授权和监管由多个国家主管当局联合组成的审核小组进行审核;
• NB必须要有自己的审核*团队,新法规下对外聘*的做法将有所限制;
• NB必须要有自己的临床*,而不能仅靠外部临床*进行相关审核。
• 新法规生效后, NB将按照新的资质要求重新授权,不符合要求的NB将会被淘汰。
• 对于已经取得CE证的企业,应密切关注其NB的新授权以及授权范围!!
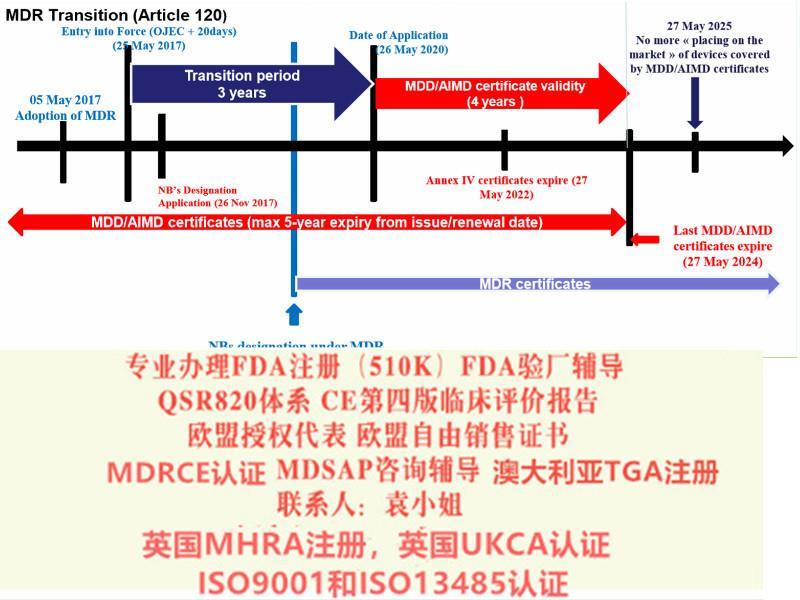
MDR&IVDR修订要点
1) 强化符合性评审程序, 临床试验和临床评估, 警戒系统和市场监督系统, 确保医疗
器械的透明和可追溯性
2) MDD + AIMD →MDR; IVDD →IVDR
3) 药品, 化妆品和食品不在MDR/IVDR的范围内
4) MDR包括含有无活性的人组织或细胞的医疗器械
5) 无医疗用途, 但功能和风险与医疗器械类似的产品也纳入MDR
6) 含纳米材料的医疗器械要进较严格的评估
定义: Commission Recommendation 2011/696/EU (OJ L 275, 20.10.2011, p.
38).
7) 电子商务服务 Information Society Service要符合Directive (EU) 2015/1535
8) 通用规范CS (Common Specification)
9) 规定经销链相关方 (Economic Operator) 的职责
10) MDD/AIMD中的Annex 的临床评估 或警戒系统纳入到了MDR的正文里
11) 医疗机构内部使用的器械
12) 缺陷产品对患者的补偿
13) 风险管理和临床评估互相依赖, 定期更新
14) 法规负责人需要满足资质要求, 负责监督和和控制医疗器械的生产, PMS和警戒
系统的活动. ---- 类似于质量授权人
15) 欧盟代表与进口商和制造商一起起到连带责任
欧盟代表资质要求, 类似于法规负责人
16) 平行贸 Parallel Trade, 特别是重新贴标签或重新包装
17) 一次性医疗器械的再加工和使用:
- 符合成员国的法规要求
- 再加工方要承担法定制造商的责任;
- 由医疗机构或外部加工方进行的一次性MD的再加工和再使用必须要符合通用
技术规范或协调标准或成员国的法规要求.
- 再加工器械的*和性能应等同于初期的一次性MD
18) 植入器械: 患者应获得基本的信息, 包括标识, 危害健康的警示或注意事项
19) 带有CE标记的MD, 在欧盟内可以自由流通和销售. 但成员国可以限制某些器械
的使用.
20) 除了定制器械外, 所有器械都应应用UDI系统 (MDR执行后1-5年)
21) EUDAMed, MD的 命名Code
22) 植入和III类产品的制造商应公开产品的主要*和性能, 及临床评估结果的概要.
- *和性能的概要应特别包括该产品在与其他诊断或**方法比较时的重要性,和二者的特殊使用条件
23) 在欧盟的层面上管理NB
24) 主管当局严格监控NB对技术文档, 特别是临床评估的评审
25) NB的飞行检查权利, 并对产品进行外观或实验室测试
26) 对输入或导出药物的III类植入产品和IIb有源产品, 欧盟*的*组应复审企业的临床评估报告, 并通告主管当局
27) III类产品和某些IIb产品, 制造商在临床评估或临床试验之前, 可以自愿地与*组联系, 咨询临床开发策略和临床试验方案.
28) 符合性评估时的产品分类: 按照国际实践分为四大类; 有源植入器械分为较高级
---- (59)
29) Class III custom-made implantable devices 需要CE认证
30) 明确CE技术文件要求(Annex II & III)
-/gjhdff/-
http://sungofda.cn.b2b168.com









