周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
我公司是做:
1:新MDR法规和MDD指令的欧盟CE认证,CE第四版评价报告更新/编写
2:欧盟自由销售证,欧盟授权代表(德国,荷兰,英国),
3:ISO9001/ISO13485认证以及咨询
4:FDA注册,FDA510K,FDA验厂/陪审和翻译
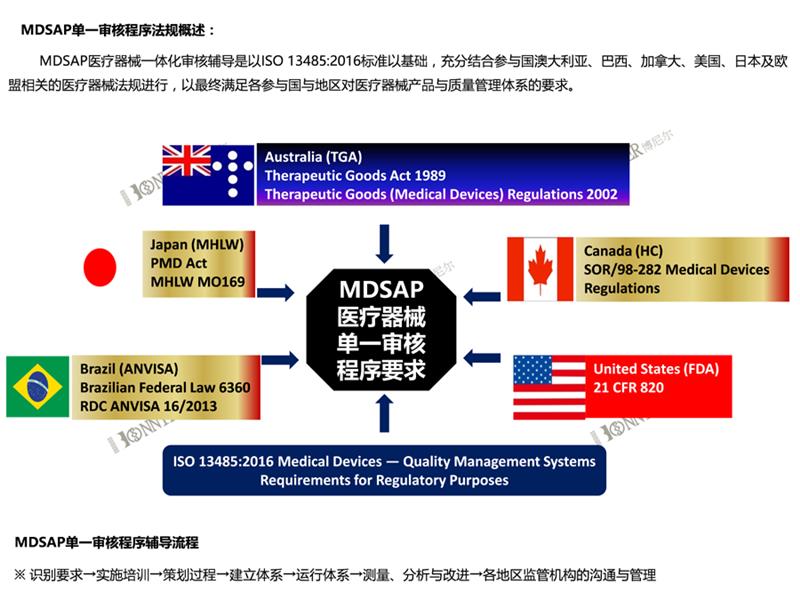
5:MDSAP咨询,国内注册证,生产许可证的办理
1.欧盟(非无菌):医用口罩、面罩、眼罩、防护服、隔离服和手套等非灭菌I类产品与检测试剂盒产品,提供技术文件、欧盟授权代表和注册凭证证办理服务。
备注:欧盟对于I类的产品,要求企业自己必须确保自己的产品符合欧盟法规,产品是*有效的,并建立相关技术文件,签署符合性声明,确定欧盟授权代表,然后到成员国主管当局注册登记之后,即可在产品加贴CE标志进入欧盟销售。
不需要公告机构参与审核发证的

在此期间,仍然可以进行以下MDD的相关活动,例如产品变更及一年期内MDD新户的申请;现有MDD客户更新的相关活动;现有MDD客户更新的申请(包括提前更新的申请);现有MDD客户重大变更的申请期。虽然MDR的正式实施有延期,但是有例外情况如:
· MDD产品的投放截止日期仍为2024年5月26日
· MDD产品供应截止日期仍为2025年5月26日。
MDR的时间,尽快启动MDR法规合规准备事宜。
确认原CE认证时的技术文件中是否含有按照Rev4原则提供的评价报告;
l 确定企业合规负责人(MDR法规要求),有相应能力、和经验来承担相应的法规工作职责。
l 修改原CE技术文件,建立质量管理体系,向具有MDR发证的认证机构提出MDR-CE认证申请,获得MDR法规下的新CE证。
2017年2月Regulation (EU) 2017/745 on Medical Devices器械法规(MDR)提案发布,同年3月,欧盟成员国一致表决同意MDR。2017年5月5日,欧盟Official Journal正式对外宣MDR法规内容。MDR新法规将取代现行的有源器械指令Council Directive 90/385/EEC on Active Implantable Medical Devices (AIMDD) (1990)以及器械Council Directive 93/42/EEC on Medical Devices (MDD) (1993)指令。原计划2020年5月26日正式实施的MDR受**影响将推迟实施时间至2021年5月26日。
能为客户在欧盟境内销售产品时出现任何问题给予及时的信息沟通与协助解决。
http://sungofda.cn.b2b168.com









