电动轮椅的瑞士注册如何办理
发货地址:上海市金山区
产品数量:9999.00套
价格:面议
周期4周
国家瑞士
有效期1年
费用来电面议
认证项目瑞士代表
什么时候需要瑞士代表?
制造商在欧盟/欧洲经济区内或者了欧盟授权代表
此时制造商享有过渡期,在过渡期截止日期之前瑞士代表即可。
对于III类器械、IIb类植入式器械和有源植入式器械:2021年12月31日
对于非植入式IIb类设备和IIa类设备:2022年3月31日
对于I类设备:截至2022年7月31日
对于系统和程序包必须在2022年7月31日**名符合第51条第5款的授权代表。
如果制造商不在欧盟或欧洲经济区内,同时又没有在2021年5月26日之前欧盟授权代表的制造商,应在2021年5月26日或者进行瑞士器械贸易时瑞士代表。
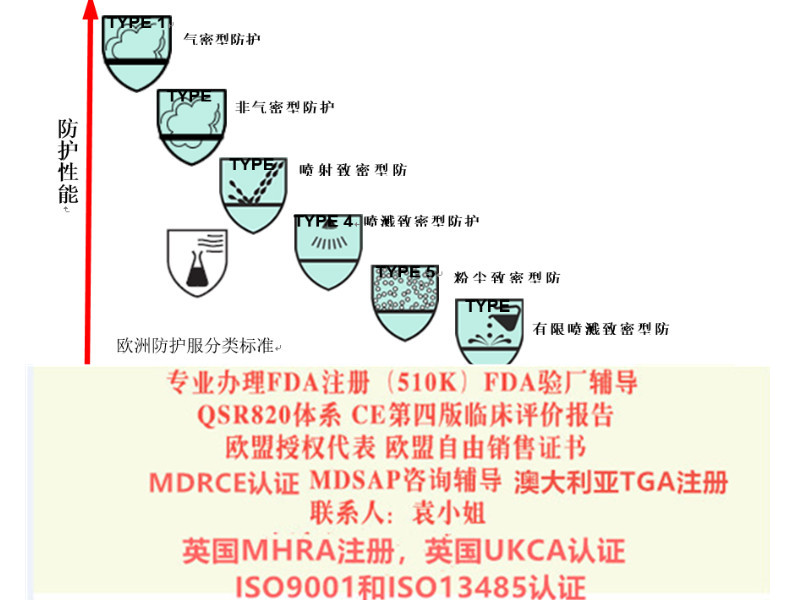
器械出口瑞士市场服务方案
如果您是生产器械的企业,希望进军瑞士市场。我们能为您提供如下的服务方案:
1、协助判定产品分类
2、瑞士MedDO法规技术文件编写
3、瑞士授权代表服务
4、瑞士注册

加贴CE产品流通有效期至2024年5月26日;
符合性证书有效至2022年5月26日;
经济运营商需在2021年11月26日之前或
投放产品三个月内进行注册
授权代表需在2021年12月31日之前将欧洲
授权代表更换为瑞士授权代表。
瑞士注册的报价原则:
瑞士注册的报价主要基于产品数量多少来决定,产品数量越多费用越高,原则上多个产品可适当打折。
鉴于IVDR的正式实施日期尚未到来,当前瑞士市场对于IVDD的管理依然按照oMedDO法规执行。
在2022年5月26日之后,瑞士当局可能会采用IVDR的相应要求,特别是考虑到IVDR的执行延期,在此日期之后瑞士对于IVD的管理尚不清楚。
http://sungofda.cn.b2b168.com









