丽水病床的MDRCE认证
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
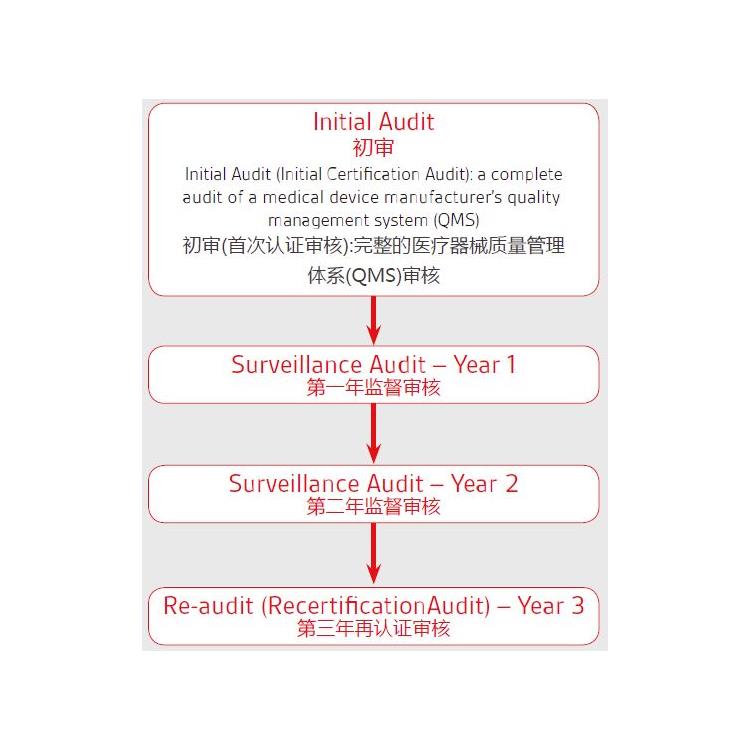
关于欧盟CE 认证的MDR 2017/745法规升级,我们该:
确认原CE的发证机构是否已获得欧盟当局批准的颁发MDR的,目前拥有该的认证机构:BSI、TUV南德(注意TUV莱茵目前还未获得批准);
FDA 510(k)
根据风险等级的不同,美国食品药品监督管理局(FDA)将器械分为三类(Ⅰ,Ⅱ,Ⅲ),Ⅲ类风险等级。
如果您计划进入美国市场,除了质量管理体系需要符合美国的GMP要求,即通常所说的QSR820,还需要进行企业注册(Registration)和产品列名(Listing)。其中,绝大部分I类器械可直接进行产品列名,少数产品还豁免GMP;大部分的II类器械,以及少量的I类和III类器械,需要向FDA提交510(k)申请,获取批准函(Clearance)后,再进行产品列名;剩下的III类器械则需要向FDA递交PMA(Premarket Application)申请,获得批准函后再进行产品列名上市。

MDR
第17 条规定,一次性使用的器械的复用只能在相应法律允许的情况下进行,且应符合MDR 的规定。任何对一次性使用器械的再处理即复用的自然人或法人应视为复用器械的制造商,承担制造商义务,包括器械的可追溯性。但目前只有部分欧盟成员国接受器械复用并具备相应的法规规定。

MDR将取代Directives 90/385/EEC (有源植入类器械指令)and 93/42/EEC(器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
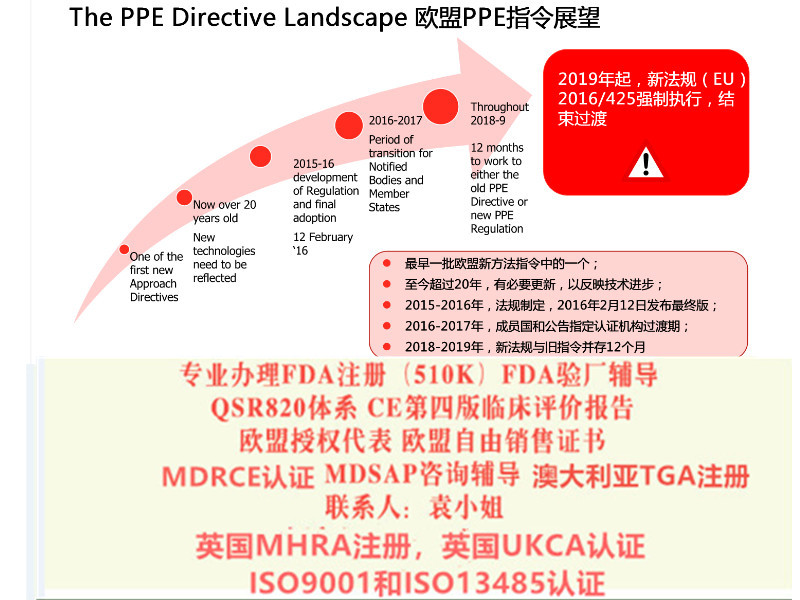
基于本版法规的器械将很大程度上提高欧盟对器械产品的要求,不论是制造商还是公告机构都将面临更严格的管理,基于目前的产品分类规则,更多的产品将需要执行公告机构参与的符合性评估流程,更多的品种纳入了器械。
我公司办理: 出口英国需要UKCA认证,英国代表,MHRA注册
http://sungofda.cn.b2b168.com