隔离衣的MHRA厂商
发货地址:上海市金山区
产品数量:123456.00个
价格:面议
规格1
密度4
宽度2
质量5
高度3
英国授权代表UK Responsible Person是什么?
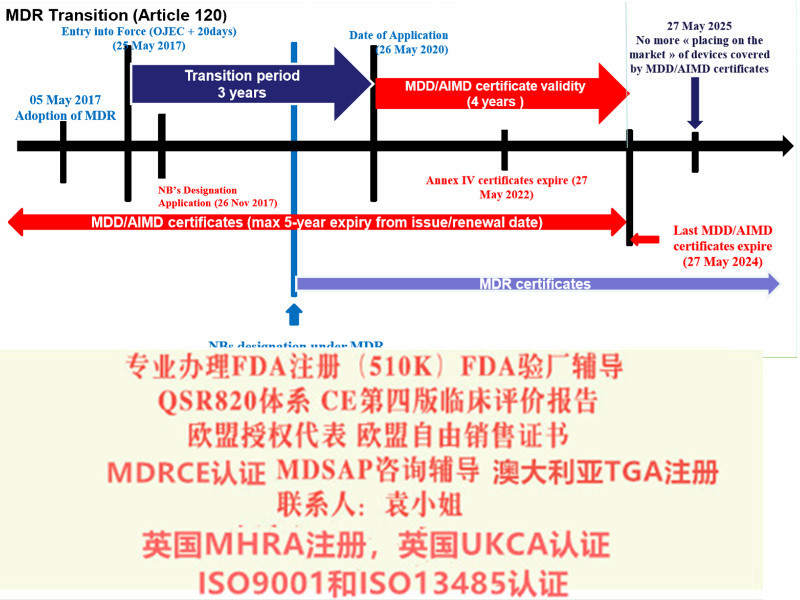
器械英国MHRA注册简介英国脱欧后,按照脱欧协议,将陆续不再认可欧盟CE认证,对于器械,CE认证在英国可继续使用至2023年6月30日,但需要持有CE认证的企业在英国当地有英国负责人(类似欧盟授权代表),由英国负责人进行MHRA注册,才能进入英国GB地区市场(英格兰,威尔士和苏格兰)。
我公司办理产品出口欧盟、美国、中东南美等的各种认证: TUV莱茵,TUV南德等CE认证(MDD/MDR法规),CE技术文件编订, CE第四版评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请),FDA美国代理人服务/ FDA QSR820验厂及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改,英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。 海牙成员国 尔巴尼亚、安道尔、安提瓜和巴布达、阿根廷、亚美尼亚、阿塞拜疆 澳大利亚、奥地利、巴哈马、巴巴多斯、白俄罗斯、比利时 伯利兹、波斯尼亚和黑塞哥维那、博茨瓦纳 文莱、保加利亚 中国香港和中国澳门 哥伦比亚、库克群岛、克罗地亚、塞浦路斯 捷克、丹麦、多米尼克,英联邦的、厄瓜多尔、萨尔瓦多、爱沙尼亚 斐济、芬兰、法国、格鲁吉亚(从2007年5月14日)德国 希腊 格林纳达 洪都拉斯、匈牙利、印度 冰岛、爱尔兰、以色列、意大利、日本 哈萨克斯坦 韩国、拉脱维亚、莱索托 利比里亚 列支敦士登、立陶宛、卢森堡、马其顿、马拉维、马耳他 马绍尔群岛、毛里求斯、墨西哥、摩尔多瓦(从2007年3月16日起) 摩纳哥、黑山、、荷兰、新西兰、纽埃 挪威、巴拿马、波兰、葡萄牙、罗马尼亚、俄罗斯联邦 圣基茨和尼维斯、圣卢西亚、圣文森特和格林纳丁斯、萨摩亚、圣马力诺 塞尔维亚、塞舌尔、斯洛伐克、斯洛文尼亚、南非、西班牙 苏里南、史瓦济兰、瑞典、瑞士、汤加、特里尼达和多巴哥 土耳其、乌克兰、英国、美国、委内瑞拉.

MHRA注册出口前,要完成在欧盟境内注册,以免进入欧盟海关时出问题。

我司作为欧盟授权代表,被英国MHRA批准可以代表企业完成注册证。注册企业信息可在MHRA查询
出口:美国FDA注册(含FDA510K申请)、 FDA QSR820验厂及整改、FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改、CE认证(CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016、欧盟授权代表、欧盟销售证书、英国BRC认证,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证(89/686/EC个人防护指令)。 MDR分类规则的主要变化 分类规则: 5-8 Invasive devices Rule 8: • 在原来基础上,明确有源植入器械或其附件属于III类; 新增假体属于III类;关 节的全部或部分置换物(除钉、楔、板和工具等组件外)属于III类;除钉、楔、 板和工具等组件外的植入性椎间盘置换物和接触脊柱的植入器械属于III类。 这部分的修订取代了现有的指令: • 90/385/EEC Active implant medical device • 2003/12/EC Breast implants raised to Class III • 2005/50/EC Hip, knee and shoulder joint replacements raised to Class III 分类规则: 9-12 Active devices Rule 9: • 在原来基础上, 增加对发射电离达到目的的有源器械,以及控制、这些器械或直接影响这些器械性能的有源器械属于IIb类; • 在原来基础上, 增加预期用于控制、监视或直接影响有源植入器械性能的有源器械属于III类。 新增Rule 11:关于软件的分类规定,可以分为I, IIa, IIb, III类: • 提供用于作出诊断或目的决策的信息的软件,属于IIa类,除非这些决定有可能影响: - 或个人健康状况不可逆转的恶化,属于III类; - 个人的健康状况或手术严重恶化,属于IIb类。 • 用于监测生理过程属于IIa类,除非用于监测重要的生理参数,其中这些参数的变化可能导致对患者的即时危险,在这种情况下的软件属于IIb类。 • 其它属于I类 分类规则: 13-22 Special rules Rule 16: • 在原来基础上, 新增用于的器械属于IIa类,除非它们是用于侵入性器械的液或清洗机,这种器械属于IIb类。 分类规则: 13-22 Special rules Rule 18: • 在原来基础上, 增加由人体的组织或细胞,或其无活性或使其无活性的物合成或制成的器械属于III类。 分类规则: 13-22 Special rules 新增Rule 19:由纳米材料合成或制成的器械的分类规则。 • All devices incorporating or consisting of nano terial are classified as: – class III if they present a high or medium potential for internal exposure; – class IIb if they present a low potential for internal exposure; and – class IIa if they present a negligible potential for internal exposure 分类规则: 13-22 Special rules 新增Rule 20: • 除侵入性器械外,其他通过人体孔道吸入方式来用的侵入性器械属于IIa类,除非它们的作用方式对用的性和有效性有至关重要的影响或用于危及生命的病症,在这种情况下属于IIb类。
MHRA注册作为加贴UKCA标记确保产品持续合规的出口英国市场的关键一步,需要制造商英国法规负责人来实施。同时还需要准备符合UK MDR 2002的技术文件,必要时注册还需要提供符合性声明和公告机构证书。
http://sungofda.cn.b2b168.com









