产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
个人防护类防护服
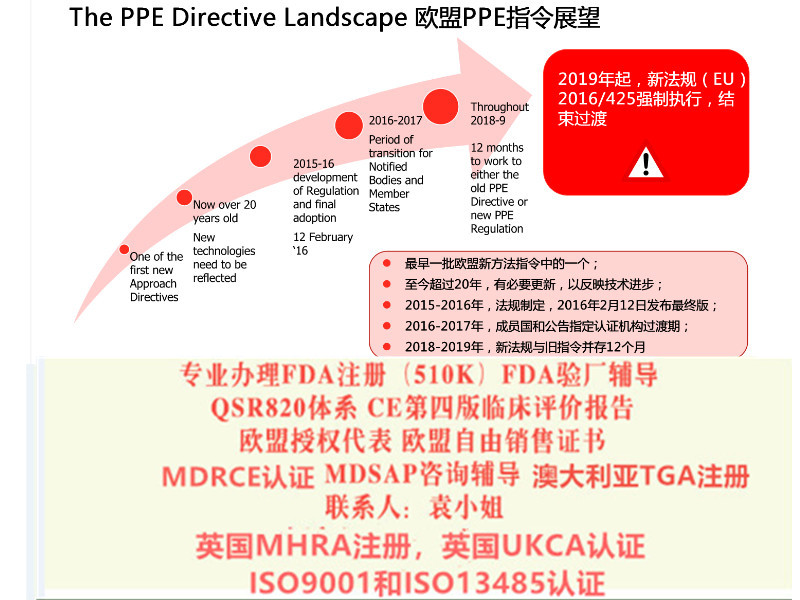
非医用防护服可以按照个人防护用品出口到欧盟,需要满足(EU)2016/425(PPE)指令。PPE将个人防护产品分为I类、II类、III类产品。
个人防护类防护服属于Ⅲ类产品,需要公告机构介入,应遵循以下流程才能满足出口欧盟的准入条件:
① 企业需将产品送到公告机构实验室进行型式检测;
② 编制产品技术文件;
③ 结合PPE法规建立体系;
④ 完成公告机构现场审核,即可获得证书。
SUNGO有丰富的欧盟注册经验。SUNGO实验室可以开展隔离衣、手术衣的性能测试和验证服务,助力客户产品顺利上市欧盟市场保驾**。
欧盟主管部门按产品的危险程度,将产品分为:Ⅰ类、Is(),Im(测量),Ⅱa类、Ⅱb类、Ⅲ类
关于I类产品申请CE认证(CE认证的新法规是:2017/745 MDR新法规)的流程如下:
1:那么I类申请CE的流程是 :
企业自己必须确保自己的产品符合欧盟法规,产品是有效的,并建立相关技术文件,签署符合性声明,确定欧盟授权代表(我们提供的欧代是荷兰公司),然后到成员国主管当局注册登记(到荷兰局CIBG注册登记)获得注册信函之后,即可在产品加贴CE标志进入欧盟销售。
不需要TUV,BSI等这些Notified Body公告机构参与审核发证书的
2:SUNGO提供的欧盟授权代表的职责的,不是Notified body公告机构,*到欧盟授权网站查询
3:终给企业的文件是:MDRCE技术文件+MDR 符合性声明+欧盟注册信函

按产品的危险程度,将产品分为Ⅰ类、Is(),Im(测量),Ⅱa类、Ⅱb类、Ⅲ类
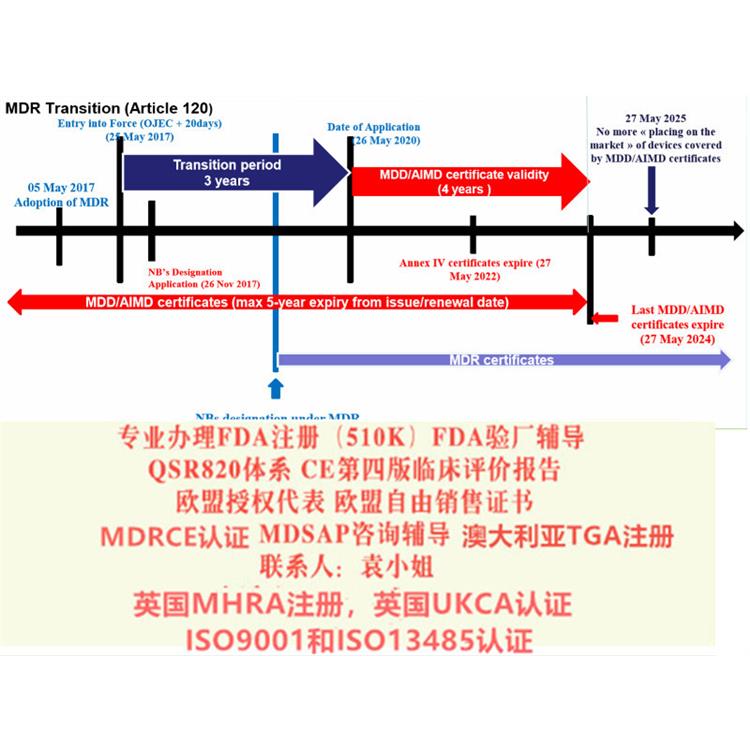
对于目前MDD和MDR的各个风险等级的产品实施时间:
1. 对于I类的产品,欧盟强制要求2021年5月25号强制实施MDR
2. 对于Is(),Im(测量),Ⅱa类、Ⅱb类、Ⅲ类迟可以用到2024年5月25号
3. 对于可重复使用的产品,在MDD里属于I类,但是在MDR里属于Ir类,那么如果企业在2021年5月25号之前满足了MDD的要求,迟可以用到2024年5月25号
给企业一些建议:
•要求的大幅增加对制造商(特别是中小企业)产生了巨大影响
•增加人才**性:制造商,机构,组,欧盟授权代表等需要熟悉法规,技术和人员
•尽早开始准备!
•检查产品分类和合规途径是否受到影响!
•内部自我检查,以确保技术文件:符合的技术要求;特别是评估!满足语言要求
•了解MDR和内部差距分析的变化
•选择一个稳定,成熟的公告机构!

至2020年5月26日,MDR法规将强制实施。至2022年5月26日IVDR法规将强制实施。至2014年,MDD/ AIMD证书全部失效。MDR新法规变化1)扩大了应用范围2)提出了新的概念和器械的定义3)细化了器械的分类4)完善了器械的通用和性能要求5)加强对技术文件的要求6)加强器械上市后的7)完善评价相关要求事故对于患者意味着伤害,对于企业的生存也具有巨大的破坏力。因此,评估的设计和数据的收集具有至关重要的意义。然而在实践中,许多制造商不清楚什么是欧盟法规所要求的评估,什么样的数据能满足欧盟的法规要求。
我公司办理:ISO13485认证,CE评估报告编写 等产品出口的相关认证
http://sungofda.cn.b2b168.com