四轮车的MHRA注册 代理
发货地址:上海市金山区
产品数量:123456.00个
价格:面议
规格1
密度4
宽度2
质量5
高度3
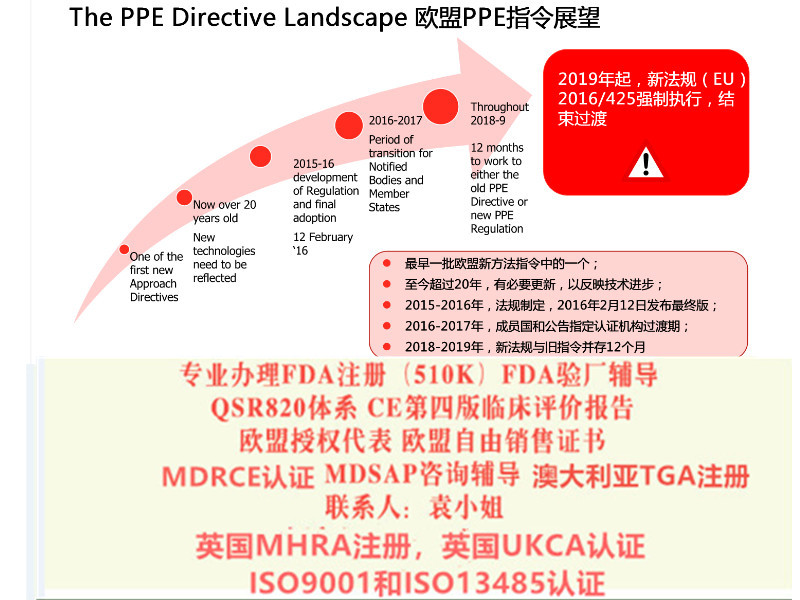
I类的器械MDD或者IVD other的产品2021年12月31日起,需要做英国的DOC,然后贴加UKCA标志 以及确定英国代表,完成MHRA注册,然后才可以出口英国
我公司办理产品出口欧盟、美国、中东南美等的各种认证: TUV莱茵,TUV南德等CE认证(MDD/MDR法规),CE技术文件编订, CE第四版评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请),FDA美国代理人服务/ FDA QSR820验厂及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改,英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。 对于公开文献的数据搜集,国内的生产商还有一个常见的错误,即没有预先建立一个搜索的策略,该策略必须囊括所有适用的数据(无论是正面的还是的),而不是选取仅仅是“好的”文献。在第四版的要求中,仅仅获得数据是没有用的,还需要“运用”这些数据来申请产品的性和有效性。“运用”包括: 按照第四版原则的要求,评价报告应当包含以下内容: (一)概要 (二)评价的范围 (三)评价的背景:当前的知识,新的技术水平 (四)评价的设备 4.1评价的类型 4.2等同性说明 4.3制造商产生和持有的数据 4.4来自于文件的数据 4.5数据的总结和审核 4.6数据的分析 (五)结论 (六)下次评价的日期 (七)日期和签名 (八)负责评价的评价者的资质 (九)参考 评价报告还应当确定并论证定期更新的频率: 如果有严重风险或者没有良好的建立风险,则至少每年1次 如果没有严重风险并且已经良好地建立了风险,则2-5年一次 当上市后数据显示对现有的评价有影响时需要主动更新! CE第四版(MEDDEV2.7.1Rev4)报告 对于生产商的一些建议 1.相比于第三版,第四版给予了更多的指南,生产商应从中考虑问题力求评估文件完整性和科学性。 2.生产商应关注第四版相比与第三版的差,使评估文件符合新法规的要求。 3.生产商除了关注CE相关法规外,也应关注本国和其他拟出口的评估要求。随着食品药品监督管理局和CE以及FDA法规当局的沟通利益密切,可以看出局的评估指南,对于CE的评估指南有一定的参考和借鉴意义。 4.生产商应将评估程序纳入质量体系,并应综合考虑拟销售的相关试验/评估的法规要求。 关于MEDDEV2.7.1Rev4,SUNGO可以协助您: 1、协助建立评价程序; 2、建立评价方案 3、寻找等同产品,进行等同分析; 4、搜索文献及其他数据; 5、数据分析; 6、完成评价报告。
我公司办理产品出口欧盟、美国、中东南美等的各种认证: TUV莱茵,TUV南德等CE认证(MDD/MDR法规),CE技术文件编订, CE第四版评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请),FDA美国代理人服务/ FDA QSR820验厂及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改,英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。 认证方案 颁证机构 Issued By: MHRA (Medicines and Healthcare products RegulatoryAgency) 持证机构 Hold By: EC REP 欧盟授权代表 欧盟自在销售证书申请流程 搜集申请方的产品信息; 签署欧盟授权代表协议,签署任命和书; 编订相关MHRA申请文件; 协助企业向MHRA提交注册申请; 与英国局当局联络沟通注册事宜; 整改申请材料直至MHRA注册; 协助企业编订销售文件; 辅佐企业准备相关申请材料; 向MHRA英国局当局提交申请; 与英国局联络沟通直至取得批准; 贵司需求配合的工作 提供贵司的根本信息,包括企业称号、企业地址、联络方式、产品称号; 提供贵司的CE产品技术文档; 填写MHRA注册申请表; 签署欧代协议。 周期:申请到获证6-8周 我司成立于2006 年1月 1 日,是一家经过美国、英国、荷兰批准成立的合资公司。特地为客户提供美国FDA认证、欧盟授权代表、 MHRA注册、 欧盟自由销售证书的申请,及证书的公证、海牙认证等方面的服务。

自由销售证书定义 自由销售证书也叫出口销售书,其英文名称为Free Sales Certificate、Certificate of Free Sale或者Certificate For Exportation of Medical Products;简称FSC 或 CFS。欧盟自由销售指的是欧盟的主管当局出具的产品可以在特定区域自由销售的文件。 SUNGO提供的服务 SUNGO可以同时办理欧代、MHRA注册以及CFS证书一站式服务。SUNGO 的CFS证书同样可以提供英国局颁发的和荷兰局颁发的。 海牙认证和认证 海牙认证/ Apostille定义 “Apostille”来源于法语,即“认证”,但与国内所指的“使领馆认证”不同。“apostille”特指1961年《海牙关于取消外国公文认证要求的公约》签约国之间相互承认的,特定的机构对公文上其主管部门所做签字、盖章的真实性予以确认的行为过程和结果,是一种特定的“认证”。 我公司办理产品出口欧盟、美国、中东南美等的各种认证: TUV莱茵,TUV南德等CE认证(MDD/MDR法规),CE技术文件编订, CE第四版评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请),FDA美国代理人服务/ FDA QSR820验厂及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改,英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。

我公司办理欧盟,美国,澳大利亚以及中东南美等等各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证 欧盟注册定义 依据欧盟法规规定,所有的MDD I类器械,客户定制器械以及IVDD的OTHER类别的器械在出口到欧盟时都需要完成欧盟注册。欧盟注册是由欧盟各个成员国的器械主管机构来实施审批的。 欧盟注册需要提供的资料 所有申请者应提供企业名称,地址等基本信息以及产品的名称和型号等信息。除此之外,还需要提品的说明书(必要时)以及公司签发的DOC(符合性声明)。 欧盟注册的种类 SUNGO可以提供英国器械企管当局MHRA的注册服务,以及荷兰器械主管当局的器械注册服务。注册信函样本请见下图:
SUNGO服务的宗旨不仅是完成项目,而是帮助客户解决问题并达成目标。所有客户均有专属服务人员,针对市场准入过程中的问题提供的支持和解答。选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的战略伙伴。
http://sungofda.cn.b2b168.com









