产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
新的标识识别系统(UDI系统)(第27条)将有力地增强市场后相关活动的可追溯性和有效性。
MDR还将提高透明度,公开有关设备和研究的信息。
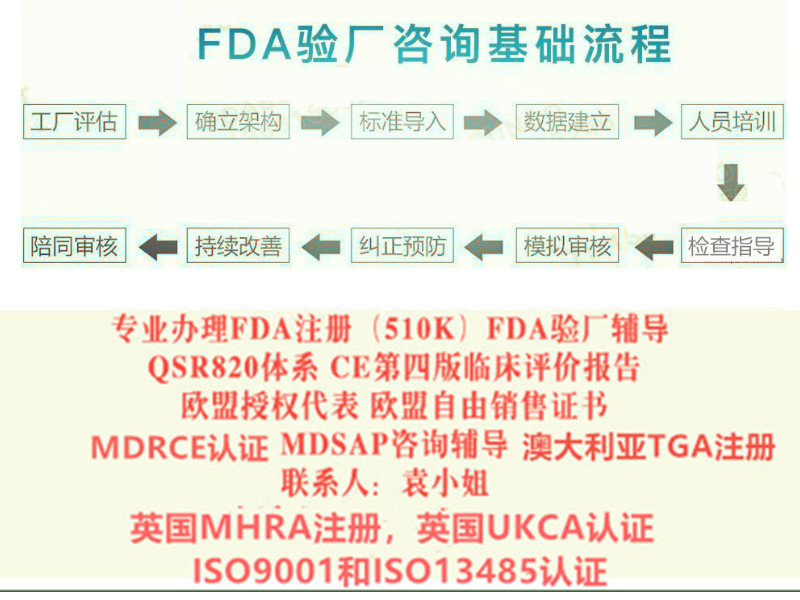
我们的服务包括:
确定您的器械在加拿大的具体分类。
代表您准备加拿大器械许可证(MDL)或加拿大器械机构许可证(MDEL)申请。
制定、实施或修改您的ISO 13485质量管理体系以满足加拿大的相关规定。
提供关于ISO 13485与加拿大器械法规(CMDR)方面的现场员工培训。
确定每年应向加拿大缴纳的许可证费用。
可以现场审计服务,确保符合ISO 13485:2003以及CMDR相关规定。
了解加拿大器械注册服务的更多信息,请联系我们
法规条款增加,认证评审更加严格
a. 分类规则增加:由MDD的18条增加到 22条;
b. 基本要求检查表条目增加:由MDD的13条增加到 MDR的23条;
c. CE技术文件的结构发生了变化,分为:产品技术文件和上市后文件(MDD只要求产品技术文件);
d.评价报告。MDR要求企业提供第四版评估报告,相比于第三版,第四版要求更为严格;
5:MDR要求更高的透明度和可追溯性
a. 引入了器械标识UDI,增加产品的可追溯性;
b. 企业的相关信息都会被收集到欧洲器械数据库(EUDAMED);
c. 建立上市后监督(PMS)系统;

给大家带来解读MDR系列讨论 部分:演变过程和MDR的过渡期。众所周知,现行的MDD 器械指令93/42/EEC是1993颁布的,距今已经有26年的历史,这期间,器械行业无论是从技术方面,应用方面都有了巨大的变革,无疑,一部用了26年的指令已经过于陈旧,新法规替代老法规已经势在必行。2010年发生的法国PIP事件也促使了欧盟推行欧盟新法规的起草和推行。

关于我国审评审批制度可借鉴的思考
基于对法规的研究,在审评审批及过程中认为有几点值得借鉴:
先是整体的理念,产品符合性评估程序中不仅包含技术文件审评与生产质量管理体系审核,还包含对上市后计划及相关警戒数据报告的审核,且上市后责任明确。在产品上市之前即明确了上市后制造商的责任和义务,并使得上市后有相应的依据。
欧盟国家出具的自由销售,目前针对器械做的比较多的是欧盟成员国的局出具的自由销售。SUNGO SUNGO Europe B.V. 可以办理。
http://sungofda.cn.b2b168.com









