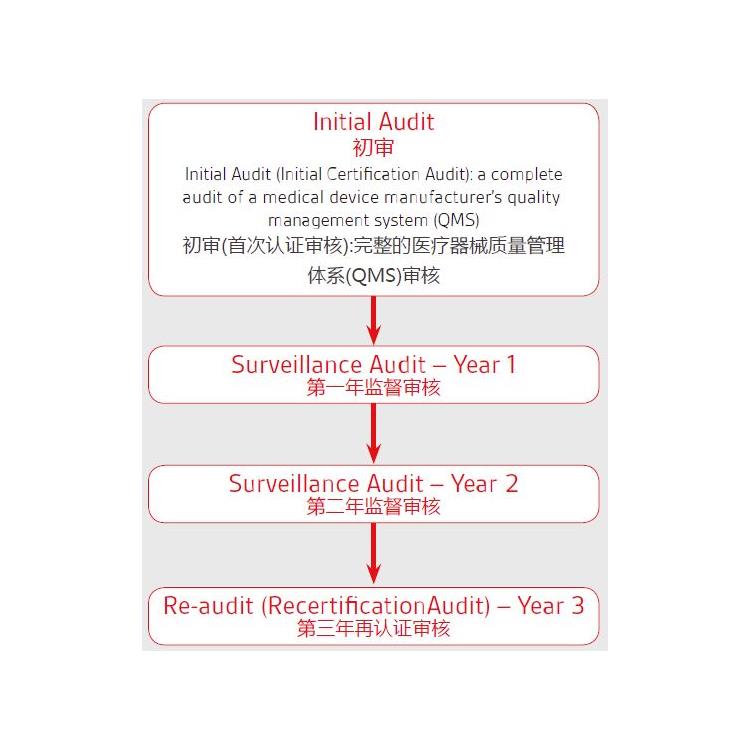
蚌埠护手的MDRCE认证
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
医用防护服、隔离衣、手术衣;产品在进入欧盟市场前,企业需根据产品的预期用途,结合欧盟器械法规(EU)2017/745中附录Ⅷ要求,将产品分为I类、II类及III类,产品风险等级越高,分类等级越高,进入欧盟市场要求越高。
欧盟主管部门按产品的危险程度,将产品分为:Ⅰ类、Is(),Im(测量),Ⅱa类、Ⅱb类、Ⅲ类
关于I类产品申请CE认证(CE认证的新法规是:2017/745 MDR新法规)的流程如下:
1:那么I类申请CE的流程是 :
企业自己必须确保自己的产品符合欧盟法规,产品是有效的,并建立相关技术文件,签署符合性声明,确定欧盟授权代表(我们提供的欧代是荷兰公司),然后到成员国主管当局注册登记(到荷兰局CIBG注册登记)获得注册信函之后,即可在产品加贴CE标志进入欧盟销售。
不需要TUV,BSI等这些Notified Body公告机构参与审核发证书的
2:SUNGO提供的欧盟授权代表的职责的,不是Notified body公告机构,*到欧盟授权网站查询
3:终给企业的文件是:MDRCE技术文件+MDR 符合性声明+欧盟注册信函

法规对各方义务的描述更为明确也更为具体,对于制造商的要求更为细化,因此新法规执行后,各方应先明确自身职责和义务,规范有序地开展生产和市场活动,应审核确认上游供应商是否符合规定,并确认能够自己的下游流程符合规定,应按照对应的警戒系统的要求进行或配合事件上报,配合完成现场纠正措施,并依据职责组织培训。

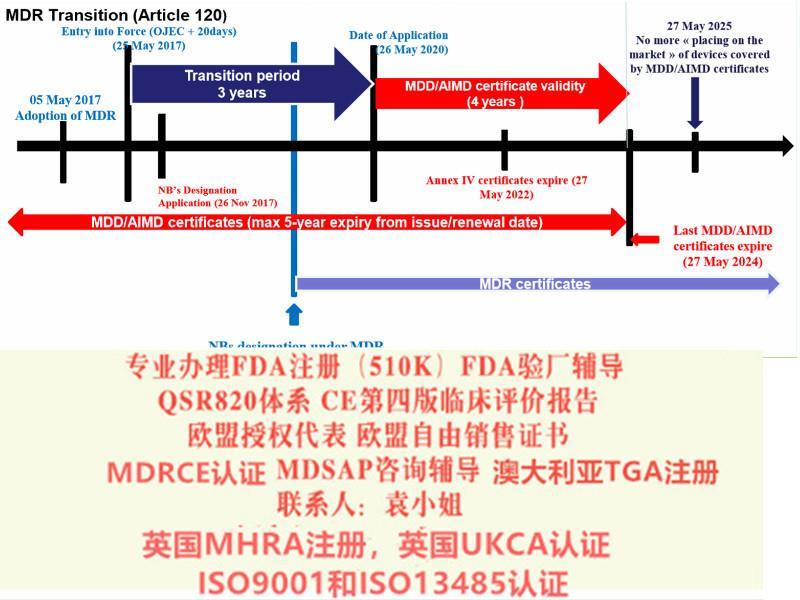
2012年,欧盟会起草了MDR和IVDR法规,当中历时了4年的时间,直到2016年6月,欧洲议会和欧盟理事会才发布MDR和IVDR的文本。
基于本版法规的器械将很大程度上提高欧盟对器械产品的要求,不论是制造商还是公告机构都将面临更严格的管理,基于目前的产品分类规则,更多的产品将需要执行公告机构参与的符合性评估流程,更多的品种纳入了器械。五、关于我国审评审批制度可借鉴的思考基于对法规的研究,在审评审批及过程中认为有几点值得借鉴:先是整体的理念,产品符合性评估程序中不仅包含技术文件审评与生产质量管理体系审核,还包含对上市后计划及相关警戒数据报告的审核,且上市后责任明确。
2021年MDR法规的实施日期逐渐临近,如何在过渡期截至前取得MDD的,如何或快速取得MDR。上海沙格有着的咨询师团队,丰富的案例经验。
http://sungofda.cn.b2b168.com