电动轮椅编写CE第四版临床评价报告 试剂CE认证临床评价报告 的难点要点
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
品牌SUNGO
公司SUNGO
流程SUNGO
国家欧洲
欧盟授权代表是您与欧洲当局的联系的桥梁,他们必须是在欧洲有实体存在。
2017年5月,欧盟会提出了新的器械法规,参考法规(EU)2017/745(以下简称:MDR2017/745)。

*各国转换为法律法规即可实施。在内容方面,MDR基于原始指令的整合,大大改进了器械认证的规范和限制,例如产品分类规则,设备可追溯性,性能研究规范,上市后产品性提高以及有效性方面和。 MDR由10章和123篇文章组成,共17个附录。关于的过渡期:仅拥有根据指令90/385/EEC和93/42/EEC颁发的证书的设备可以投放市场,前提是自MDR应用之日起设计和预期用途没有发生重大变化且符合要求新规定。

企业准备UKCA合格评定注意事项 从目前公告机构的安排来看,部分位于英国的原公告机构已经准备了认证证书转换方案。这类机构会自动获得UKCA认证机构的。通常如果持有该机构原签发的CE证书可以进行转换,同时也受理原先持有欧盟其他公告机构的CE证书的客户的转换申请。

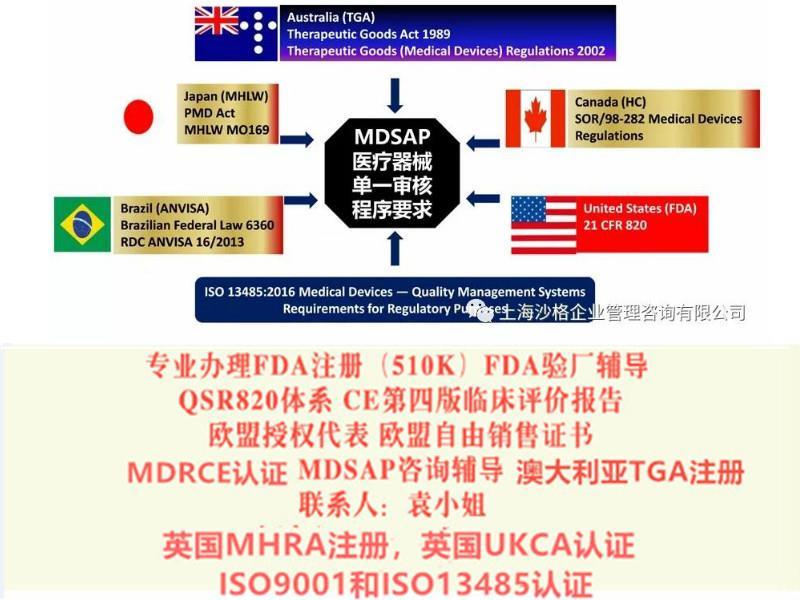
为了顺利出口欧盟以及出口英国,请及时办理新MDR法规的CE以及UKCA认证 我司可以办理: 1:欧盟MDR CE,欧盟授权代表,欧盟注册 2:英国代表,英国MHRA注册,UKCA认证 3:美国FDA注册,FDA510K 4:国内的器械注册证和生产许可证 5:加拿大的MDEL注册 6:ISO13485咨询和认证
SUNGO依靠这些资源,我们为**的器械生产商和经营者提品全生命周期的市场准入服务。
http://sungofda.cn.b2b168.com