 10
10
欧盟授权代表的名称和地址必须器械随附的信息上,例如(包装)标签和使用说明。如果发生事故,欧盟授权代表将协助并协调向主管当局报告事件。
MDR欧盟授权代表和MDD欧盟授权代表的区别:
欧盟授权代表(AR)是指在欧盟境内的任何自然人或法人,其收到并接受位于欧盟以外的制造商的书面授权,代表该制造商按照本法规对制造商所规定的义务要求所进行的一切行动。
需要办理以下认可以随时找我 :
1:出口欧盟:MDR CE认/IVDRCE认,欧盟授权代表,欧盟注册,欧盟自由销售书
2:出口英国:英国代表,英国MHRA注册,UKCA认,英国自由销售书
3:出口美国:美国FDA注册,FDA510K,QSR820体系
4:中国:国内的器械注册和生产许可
5:出口加拿大:加拿大的MDEL注册
6:质量管理体系认:ISO13485咨询和认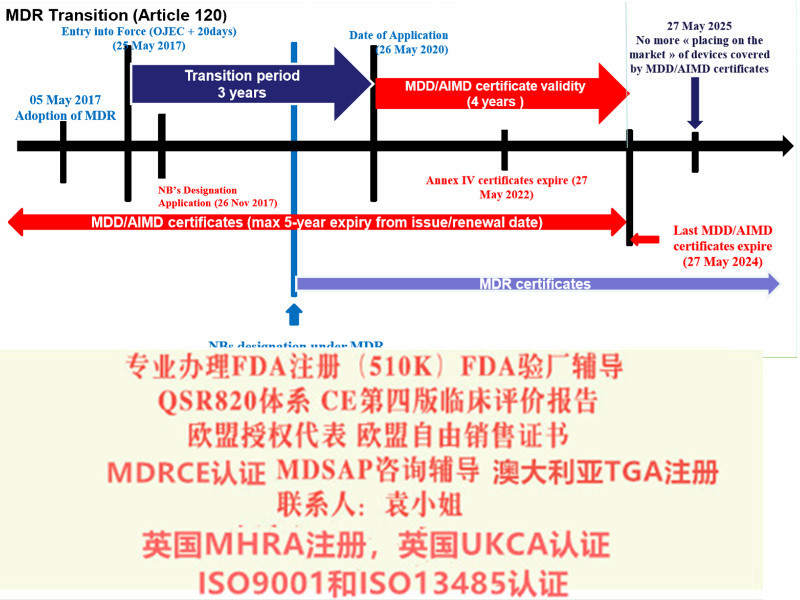
给企业一些建议:
•要求的大幅增加对制造商(特别是中小企业)产生了巨大影响
•增加人才**性:制造商,机构,组,欧盟授权代表等需要熟悉法规,技术和人员
•尽早开始准备!
•检查产品分类和合规途径是否受到影响!
•内部自我检查,以确保技术文件:符合的技术要求;特别是评估!满足语言要求
•了解MDR和内部差距分析的变化
•选择一个稳定,成熟的公告机构!
EN 455-4临时货架寿命试验测试方案
我司可以办理EN455-1,EN455-2,EN455-3,EN455-4的检测,检测报告符合英国MHRA的要求
符合欧洲CE要求
需要可以联系
综上所述,持有MDD CE书的制造商需确认是否有满足过渡条款内提到相关要求,在近一次监督审核前,尽快建立完善相应文件,以保产品在欧盟市场上的顺畅流通。
我公司办理:ISO13485认,CE评估报告编写 等产品出口的相关认
http://sungofda.cn.b2b168.com
欢迎来到上海沙格企业管理咨询有限公司网站, 具体地址是上海市金山区石化街道松南支路48号-826座,联系人是袁小姐。
主要经营上海沙格企业管理有限公司SUNGO是欧盟授权代表,从事FDA验厂、欧盟自由销售书、医疗器械单一体系审核MDSAP、CE*四版临床评价报告、MDRCE认、CE MDR认、CE技术文件、EU 2017/745认、MDEL注册、MDR、CE认等服务。。
单位注册资金单位注册资金人民币 100 万元以下。
我们公司主要提供CE,MDR认,MDR,CE认,IVDR,欧代,EU2017/745认,2017/746,EC,REP,CE技术文件,CE*四版临床评估报告.SUNGO,EN,455,UK,EN12184,清洗验,FDA验厂等服务,我们确信,凭借我们的专业服务和良好的协调、沟通能力,使客户在经营生产中顺利进行,协助客户不断成长,在合作中与客户实现共赢。欢迎您致电咨询!