洗澡椅的MDR CEMDR CE EU 2017-745认 医疗器械法规MDR 完整版
更新时间:2025-04-18 浏览数:1
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
个人防护类防护服:非医用防护服可以按照个人防护用品出口到欧盟,需要满足(EU)2016/425(PPE)指令。PPE将个人防护产品分为I类、II类、III类产品。
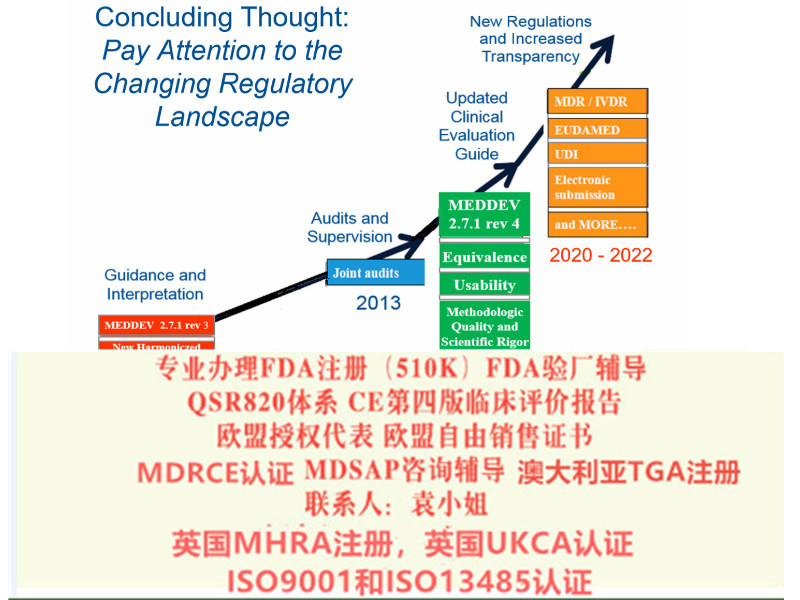
2017年5月,欧盟会提出了新的器械法规,参考法规(EU)2017/745(以下简称:MDR2017/745)。

欧盟器械法规MDR (EU)2017/745第120条过渡性条款(Article 120 Transitional Provisions)应运而生。 MDD CE的持制造商应符合Article 120条款要求,避免在宽限期严重不符合项的产生。 Article 120中需要关注的2个时间点: 1、2020年5月26日后,CE书上的任何内容不再发生变化,已上市产品不能发生重大变更,如有变更,需要重新申请MDR书。 2、2024年5月27日,MDD&AIMDD颁发的所有书失效。 MDD CE的持制造商需关注的两个方面: 1、基于MDD/AIMDD投放市场的产品,在2025年5月27日前可在市场上继续流通或投入使用。即若产品已进入市场且书在有效期内,那么产品在市场上可以继续流通、使用,截至2025年5月27日。 2、2020年5月26日后,产品需满足MDR新规关于上市后监督、警戒、市场、经济营运商与产品注册的相关要求,以上要求对于企业至关重要,请听S君细细道来。 需要办理以下认可以随时找我 : 1:出口欧盟:MDR CE认/IVDRCE认,欧盟授权代表,欧盟注册,欧盟自由销售书 2:出口英国:英国代表,英国MHRA注册,UKCA认,英国自由销售书 3:出口美国:美国FDA注册,FDA510K,QSR820体系 4:中国:国内的器械注册和生产许可 5:出口加拿大:加拿大的MDEL注册 6:质量管理体系认:ISO13485咨询和认
欧盟器械新法规MDR主要变化情况介绍 关于经济运营商各方义务 法规在第I章第2条定义中提出了“经济运营商”的概念,经济运营商是指制造商、授权代表、进口商、经销商以及任何对系统或手术包类器械进行组合或并投放市场的自然人或法人。即在符合法规规定情况下负责器械生产(包括组合或)、销售及上市后运营的自然人或法人。

MDRCE认,CEMDR认,编写CE技术文件,CE第四版评价报告,(MDRCE技术文件:Medical Device Regulation 2017/745/EU) 我公司是做: 新MDR法规和MDD指令的欧盟CE认,CE第四版评价报告更新/编写 欧盟自由销售书,欧盟授权代表(德国,荷兰,英国), ISO9001/ISO13485认以及咨询 FDA注册,FDA510K,FDA验厂/陪审和翻译 MDSAP咨询,国内注册,生产许可的办理
SUNGO SUNGO Europe B.V. 总部位于荷兰,提供技术服务。主要业务是根据欧洲立法和国际标准,为客户提供完整的技术解决方案。SUNGO集团凭借**网络和队伍为**客户提供法规,在器械行业尤为专长。提供欧盟授权代表服务,可以为客户减少中间环节,节约时间和费用,使您的产品在符合现行欧盟法规的情况下进入市场的程序简单化。
http://sungofda.cn.b2b168.com