兰州护腕的MDRCE认证-需要什么材料
发货地址:上海市金山区
产品数量:9999.00个
价格:¥1234.00 元/个 起
产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
关于欧盟CE 认证的MDR 2017/745法规升级,我们该:
根据TUV莱茵消息,5月份以后将不再接MDD指令的CE订单,且现在接的订单企业必须在8月31日之前接受审核。
由此可见,接下来将会是II类CE的一个申请高峰期,毕竟MDR的费用会比MDD高很多。
法规首先规定了制造商的义务,涵盖生产、合规、上市后的产品全生命周期,但法规同时规定,经销商、进口商或其他自然人或法人在向市场提供以其名字、注册商标命名的器械时应承担制造商相应的义务,也包括变更相应器械预期用途或变更其他影响其符合性的事项的情况。在上市后要求中,经济运营商同时负有相应的责任和义务。

MDR 由指令升级为法规,提高了对欧盟成员国的约束力,具有直接约束性,*各国转化为本国的法律法规的形式即可落实实施。内容上,MDR 在整合原指令的基础上,大幅提升了有关医疗器械认证的规范和限制,例如关于产品分类规则、器械的可追溯性、性能研究的规范、增加上市后的产品*性和有效性的等方面。MDR 共10 章123 条,并附有17 个附录。
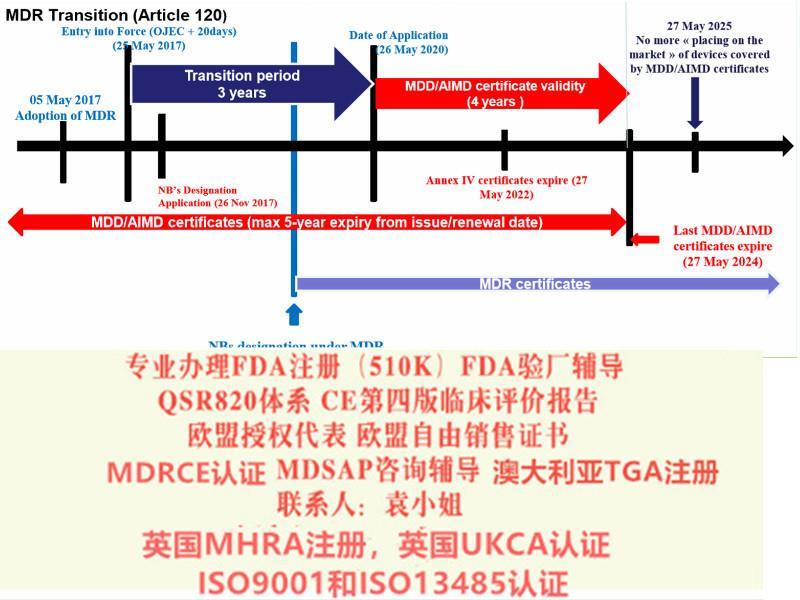
对于特定Ⅲ类器械和Ⅱ b 类器械产品,在已委派必要的器械协调小组(MDCG)、小组前提下,同样可通过指令豁免在2020 年5 月26 日之前投放市场。
法规关于公告机构的要求(正文第35~50 条) 自2017 年11 月26日起适用,即公告机构在新法规发布后的六个月内即应开始进行相应的申请,符合要求后方可依据新法规开展符合性评估。
同时法规对成员国主管机构的和MDCG 的成立也设定了期限,要求于2017 年11 月26 日前完成。对于成员国主管机构之间的协调,设定期限为2018 年5 月26 日。

2017 年4 月5 日,欧洲议会和理事会正式签发了欧盟关于器械第2017/745 号法规(MDR,EU2017/745),5月5日,欧盟(Official Journal of the EuropeanUnion) 正式发布该法规。2017 年5 月25 日,MDR 正式生效, 替代了原器械指令(MDD,93/42/EEC)和主动植入式器械指令(AIMD,90/385/EEC)。
在过渡期结束后,制造商是否仍然可以投放市场/投入使用符合指令的设备? 是的,在某些条件下,可以选择继续投放市场/投入使用符合指令的设备,直到其现有证到期为止。 这可以避免在MDR下立即需要新证。 要使用此选项,所有现有证必须有效(例如,QMS),设备的目的和性质不得更改,并且您必须遵循新的MDR规则进行注册,监视和警惕。
http://sungofda.cn.b2b168.com









