周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
sungo可以办理国内的器械注册证和生产许可证
欧盟授权代表
对于在欧盟市场流通的产品,为了实现产品的可追溯性以及便于和保护欧盟消费者等目的,欧盟在某些特定指令中要求欧洲经济区以外国家的制造商必须欧盟授权代表(European Authorised Representative,简称EAR)履行欧盟相关的指令和法律对该制造商所要求的特定的职责。简言之,欧盟对高风险领域(器械)实施了设立欧盟授权代表要求,是便于直接,落实责任而制定的法律要求。

(一)制造商是否需要一个EAR
为符合上述欧盟设立EAR的要求,中国制造商如果在欧盟成员国或欧盟经济区或双边协议国境内没有商业注册,且从事制造出口体外诊断设备、器械、有缘可植入器械等CE指令中要求的产品时,则需要相应法律实体或自然人作为自己的欧洲授权代表。
(二)EAR应帮助制造商履行哪些职责
依据欧盟法规,EAR承担相应职责包括以下内容:
1.法律职责和具体内容
1)通知主管当局制造商;
2)通知主管当局制造商的产品;
3)通知主管当局产品的变更;
4)向主管当局通报表现特征;
5)起草有关设备性能评估的声明;
6)**条款中作为欧盟会的联系方;
7)可启动合格评定程序;
8)根据主管当局的要求向其提供技术文件;
9)接受主管当局事件的通知;
10)公告机构和制造商之间的接口;
11)如果错误地贴上CE标志,授权代表必须终止侵权行为;
12)对于用于研究的设备,授权代表应遵循规定的程序并通知主管当局。
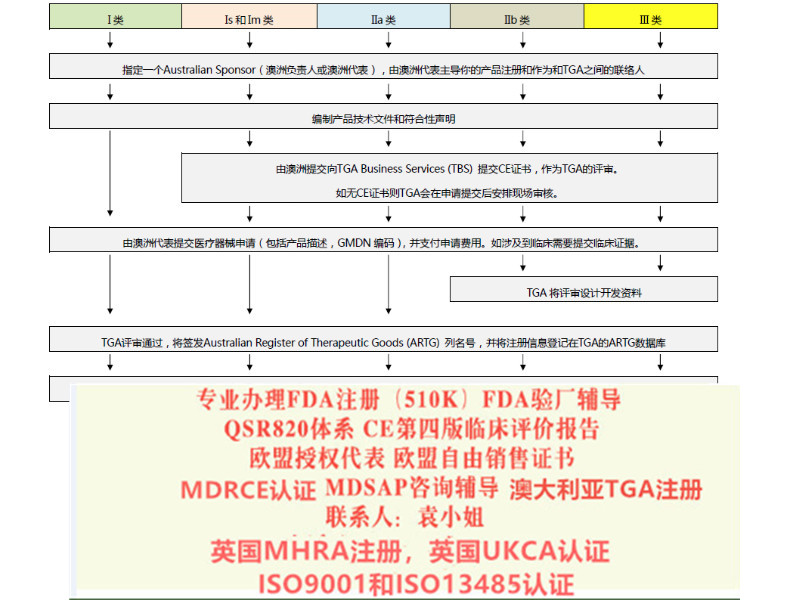
我们该怎么办?
l 重新确认产品风险分类等级,确认是否有风险等级升级的情况?
例如部分可重复使用的器械,原属于ClassⅠ的器械,按照新法规变成了ClassⅠ*类器械。美容类产品原MDD下不属于范围,现MDR法规中已纳入;
l 确认原CE证的发证机构是否已获得欧盟当局批准的颁发MDR证的,目前拥有该的认证机构:BSI、TUV南德(注意TUV莱茵目前还未获得批准);
l 确认原CE认证时的技术文件中是否含有按照Rev4原则提供的评价报告;
l 确定企业合规负责人(MDR法规要求),有相应能力、和经验来承担相应的法规工作职责。
l 修改原CE技术文件,建立质量管理体系,向具有MDR发证的认证机构提出MDR-CE认证申请,获得MDR法规下的新CE证。

1. 基于欧盟的器械法规MDR 2017/745的规定,医用口罩,手术衣,隔离衣等产品如果是非灭菌的,那么在欧盟属于I类, 这些均属于制造商自我声明产品。制造商应按相关指令要求:维护CE技术文件、发布符合性声明、确定欧盟授权代表,完成产品在欧盟主管当局的注册之后便可以贴加CE标志,欧洲销售。SUNGO 提供的服务包括:1)提供欧盟授权代表,授权在标签和说明书中使用EU REP 信息
2)修订和编制符合MDR 的CE技术文件
3)申报欧盟注册
4)企业编订符合声明:
无论按照MDD指令或者MDR法规,口罩、隔离服等产品均属于I类产品。如果产品是非无菌的,根据MDD或MDR要求,I类非无菌器械*公告机构介入。
I类非无菌产品出口欧盟要求:
1. 编制CE技术文档
2. 产品送检,取得产品检测报告
3. 出具自我符合性声明
4. 由欧代在其所在欧盟成员国主管当局(如CIBG、MHRA)进行信息注册并保存制造商的技术文档副件。
5. 在产品包装、标签上标记CE标志
2) I类无菌器械:
若产品是I类无菌器械,则需要公告机构介入,有一个较长的审核周期。
I类无菌器械销往欧盟要求:
1. 编制产品技术文档
2. 建立ISO13485体系
3. 产品送检,取得产品检测报告
4. 接受公告机构的现场质量体系审核和技术文档审查
5. 获得具备相应的公告机构出具的CE认证
6. 由欧代在其所在欧盟成员国主管当局(如CIBG、MHRA)进行信息注册并保存制造商的技术文档副
7. 在产品包装、标签上标记带有公告机构号的CE标志
SUNGO将秉承一贯“服务、客户”的原则,依托的技术团队,优化我们的服务,让更多的器械合法、*进入市场,为器械行业健康发展贡献力量。
http://sungofda.cn.b2b168.com









