保定MDRCE认型号
更新时间:2025-05-02 浏览数:25
所属行业:
商务服务 认服务
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
法规条款增加,认评审更加严格, CE技术文件的结构发生了变化,分为:产品技术文件和上市后文件(MDD只要求产品技术文件);
关于MDR涵盖产品范围和分类规则:器械的分类继续以前的类别,根据风险等级分为四类:I,II a,II b,III。但是,分类规则从18增加到22.具体分类规则的条件和变化如下:关于经济运营商的义务:该法规在章第2条的定义中提出了“经济运营者”的概念。
制造商是否需要一个EAR
为符合上述欧盟设立EAR的要求,中国制造商如果在欧盟成员国或欧盟经济区或双边协议国境内没有商业注册地址,且从事制造出口体外诊断设备、器械、有缘可植入器械等CE指令中要求的产品时,则需要相应法律实体或自然人作为自己的欧洲授权代表。

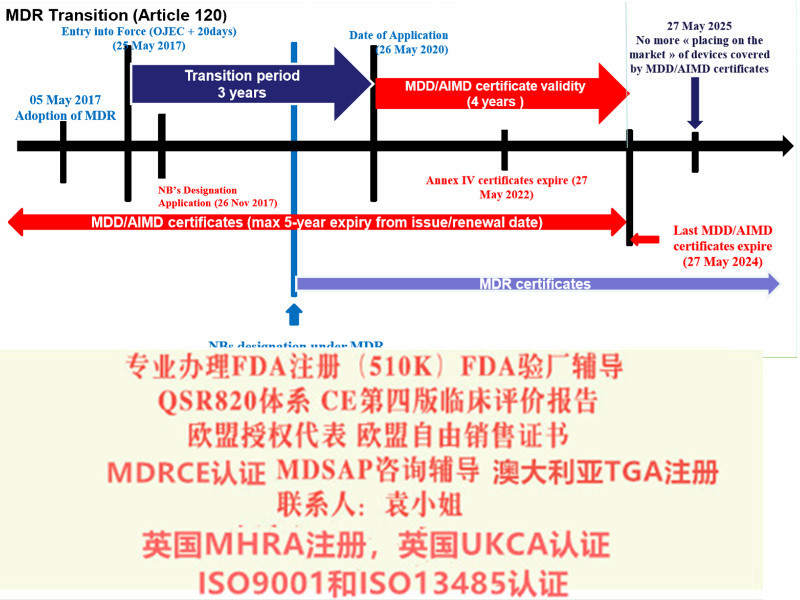
MDR于2017年5月发布,标志着MDD和AIMDD之间为期三年的过渡期的开始。在过渡期间,MDR将逐步生效,先是与公告机构和制造商根据MDR申请新书的能力有关的规定。过渡期将于2020年5月26日,即MDR法规的“适用日期”(DoA)结束。从那时起,MDR将完全适用。

MDR欧盟授权代表和MDD欧盟授权代表的区别:
欧盟授权代表(AR)是指在欧盟境内的任何自然人或法人,其收到并接受位于欧盟以外的制造商的书面授权,代表该制造商按照本法规对制造商所规定的义务要求所进行的一切行动。
需要办理以下认可以随时找我 :
1:出口欧盟:MDR CE认/IVDRCE认,欧盟授权代表,欧盟注册,欧盟自由销售书
2:出口英国:英国代表,英国MHRA注册,UKCA认,英国自由销售书
3:出口美国:美国FDA注册,FDA510K,QSR820体系
4:中国:国内的器械注册和生产许可
5:出口加拿大:加拿大的MDEL注册
6:质量管理体系认:ISO13485咨询和认
SUNGO可以在过渡期内为提供新旧法规的咨询服务,包括:
协助判定产品分类
协助选择合理的符合性途径
协助选择合适的认机构
制定认的解决方案
协助完成评估
编写CE技术文件
欧盟代表服务
http://sungofda.cn.b2b168.com









