MDSAP试点计划开始于2014年1月1,计划MDSAP项目于2019年1月1开始*实施。

SUNGO公司介绍
SUNGO GROUP:
SUNGO TECHNICAL SERVICE INC美国公司;
SUNGO Certification Company Limited英国公司
SUNGO Europe B.V.荷兰公司;
SUNGO Cert GmbH德国公司;
SUNGO Australia澳大利亚公司;
上海沙格企业管理咨询有限公司(中国)
上海沙格企业管理咨询有限公司武汉分公司
上海沙格企业管理咨询有限公司广东分公司
SUNGO集团凭借**网络和专业队伍为**客户提供法规性服务,在医疗器械行业尤为专长。
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认(CE整套技术文件编订、 CE第四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认、欧盟授权代表、欧盟自由销售书、防护服PPE指令Type5/6认
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册、生产备案登记表、生产许可、经营许可、ISO9001/13485认辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售。
出口其余国际法规:医疗器械单一体系审核MDSAP认、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
上海沙格企业管理咨询公司已经在国内近千家客户提供了相关服务,也受美国几家大型采购集团委托,对其在中国的供应商进行二方审核工作,我们的客户集中在无纺布行业企业、敷料耗材、病床、轮椅、体外诊断医疗器械行业、大型饲料机械设备企业、电子电器行业类别。公司一直秉承“专业辅导、增值服务、国际品质、本土价格”的方针,为客户提供优质的服务。
我们服务过的部分**企业及上市公司有:
新华医疗、鱼跃医疗、威高集团、阳普医疗、艾迪尔医疗、驼人医疗、恒安集团、康德莱集团、阿蓓纳、上海联影、上海复旦医疗、微创骨科医疗、普罗医学、凯利泰、联医医疗、羚锐制药、江西3L、正昌集团、杭州可靠、台钜集团、维达集团、青岛光电、科勒、暴龙眼镜等等

美国:MDSAP替代FDA的常规检查(FDA专项和P产品除外);

医疗器械单一体系审核MDSAP认咨询辅导
● 医疗器械行业从业16年经验,医疗器械法规、体系咨询师
● 精通医疗器械CFDA,FDA,CE法规
● 熟练掌握ISO13485/YYT 0287, ISO14971/YYT 0316, QSR820, JGMP, GMP 质量体系等
● 擅长美国FDA QSR820医疗器械辅导,熟练掌握QSR820各难点子系统的要求
● 具有几十家医疗器械企业咨询辅导成功经验和案例,帮助企业*美国FDA QSR820的审核,并部分企业获得零缺陷通过;并辅导企业获得ISO13485书及CE书,CMDCAS书等。主要辅导的企业包括:新华医疗,怡和嘉业,河北普康等
●对于美国法规有经验丰富的专业团队,能够及时高效的提供服务。目前我们是国内一一家成功提供了FDA警告信解除和黑名单移除辅导的咨询机构
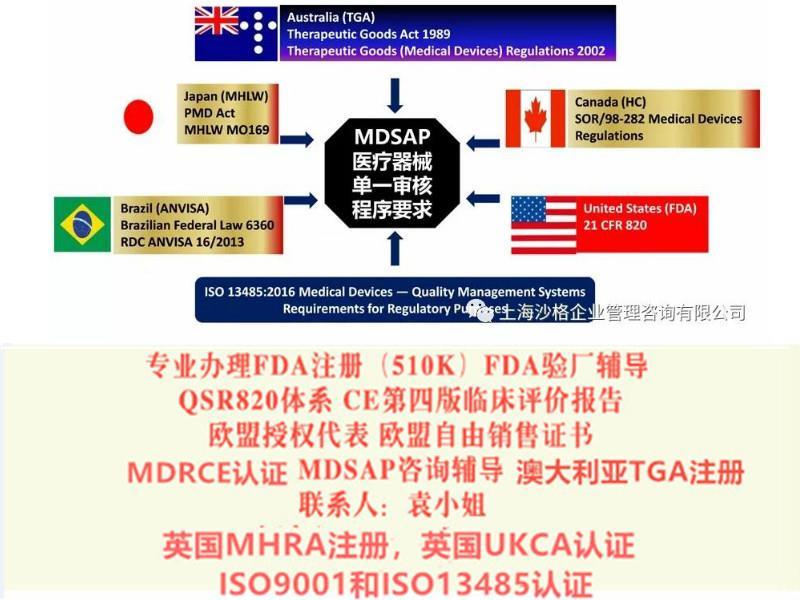
一、医疗器械单一审核(MDSAP)总体目标与项目背景,:
医疗器械单一审核(MDSAP)旨在通过单一质量管理体系(QMS)审核使制造商满足参与国的QMS要求。该程序由国际医疗器械监管者论坛(IMDRF)以及以下目前参与IMDRF的监管机构共同创建:美国食品和药物管理局(FDA)、加拿大卫生部、澳大利亚药物管理局(TGA)、日本医药与医疗器械局(PMDA)以及巴西国家卫生监督局(ANVISA)。
二、国际医疗器械监管机构论坛:IMDRF取代GHTF,IMDRF国际医疗器械监管机构论坛管理**成员:
1、US Food and Drug Administration (FDA)美国
2、Health Canada Medical Devices Bureau加拿大
3、Brazilian Health Surveillance Agency (ANVISA)巴西
4、Australia Therapeutic Goods Administration (TGA)澳大利亚
5、European Commission Directorate General Health and Consumers欧盟
6、Japan Pharmaceuticals and Medical Devices Agency (PMDA)日本
7、China Food and Drug Administration中国
8、Russian Ministry of Health俄罗斯
三、MDSAP参与的监管国家:
1、US Food and Drug Administration (FDA)美国
2、Health Canada Medical Devices Bureau加拿大
3、Brazilian Health Surveillance Agency (ANVISA)巴西
4、Therapeutic Goods Administration of Australia (TGA)澳大利亚
5、Japan’s Ministry of Health, Labour and Welfare, and the Japanese Pharmaceuticals and Medical Devices Agency日本
四、MDSAP观察员:
1、European Commission欧盟
2、The World Health Organization (WHO)世界卫生组织
五、参与的监管机构对MDSAP的接受程度:
MDSAP试点计划开始于2014年1月1号,计划在2016年度结束,MDSAP项目于2019年1月1号开始*实施。
-/gjhdff/-
http://sungofda.cn.b2b168.com