周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
SUNGO从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。
欧代职责:
1. 代表欧盟非制造商与欧盟主管当局打交道
2. 欧盟代表保存的,贴上CE标志产品的技术文件,确保随时及时的提供给欧盟主管当局审查。
3. 根据非欧盟制造商建立的警戒系统程序,欧盟授权代表协助其进行产品事故报告,召回等
4. 能为客户在欧盟境内销售产品时出现任何问题给予及时的信息沟通与协助解决。

我们该怎么办?
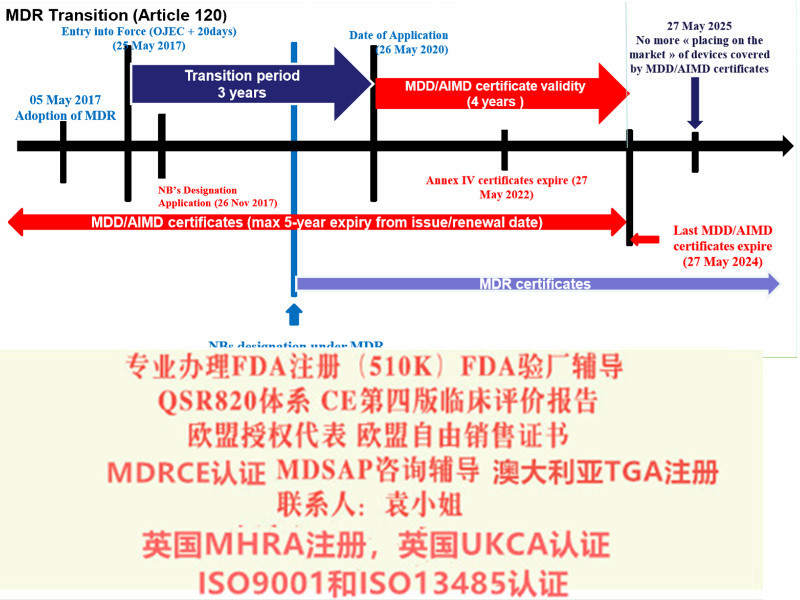
l 重新确认产品风险分类等级,确认是否有风险等级升级的情况?
例如部分可重复使用的器械,原属于ClassⅠ的器械,按照新法规变成了ClassⅠ*类器械。美容类产品原MDD下不属于范围,现MDR法规中已纳入;
l 确认原CE证的发证机构是否已获得欧盟当局批准的颁发MDR证的,目前拥有该的认证机构:BSI、TUV南德(注意TUV莱茵目前还未获得批准);
l 确认原CE认证时的技术文件中是否含有按照Rev4原则提供的评价报告;
l 确定企业合规负责人(MDR法规要求),有相应能力、和经验来承担相应的法规工作职责。
l 修改原CE技术文件,建立质量管理体系,向具有MDR发证的认证机构提出MDR-CE认证申请,获得MDR法规下的新CE证。

欧盟授权代表(European Authorized Representative)是指由位于欧洲经济区EEA(包括EU与EFTA)的制造商明确的一个自然人或法人。该自然人或法人可代表EEA的制造商履行欧盟相关的指令和法律对该制造商所要求的特定的职责。
1)提供欧盟授权代表服务的公司是:SUNGO SUNGO Europe B.V. 该公司位于荷兰,为客户提供欧洲法规技术服务。凭借其能力,已经得到了荷兰局的认可提供相关技术服务,同时也被DNV, TUV等国际认证机构认可。目前已经为数百家客户提供了欧盟授权代表服务,为数百家客户提供了欧盟注册服务,同时还为一些客户提供了欧盟自由销售服务。
2)欧盟代表服务内容包括作为企业的联络人,负责处理欧盟市场上所有的客户投诉,、注册等业务。
3)五年有效期内一次清,无年度监督费用。

Class I:
1. 为申请Medical Device Establishment License (MDEL)准备相应的技术文件
2. 提交MDEL申请,支付行政收费。
3. 申请评审通过,将在Health Canada网站公示。
Class II:
1. 通过CMDCAS认可的认证机构进行ISO 13485 审核认证(体系审核除ISO13485要求外还要包括CMDR的要求),获得证。
2. 准备Canadian Medical Device License (MDL)申请。
3. 提交MDL申请,并交纳行政收费。
4. Health Canada评审MDL申请, 评审通过后进行网站公示。
SUNGO SUNGO Europe B.V. 总部位于荷兰,提供技术服务。主要业务是根据欧洲立法和国际标准,为客户提供完整的技术解决方案。
http://sungofda.cn.b2b168.com