周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
sungo可以办理ISO13485咨询和认证
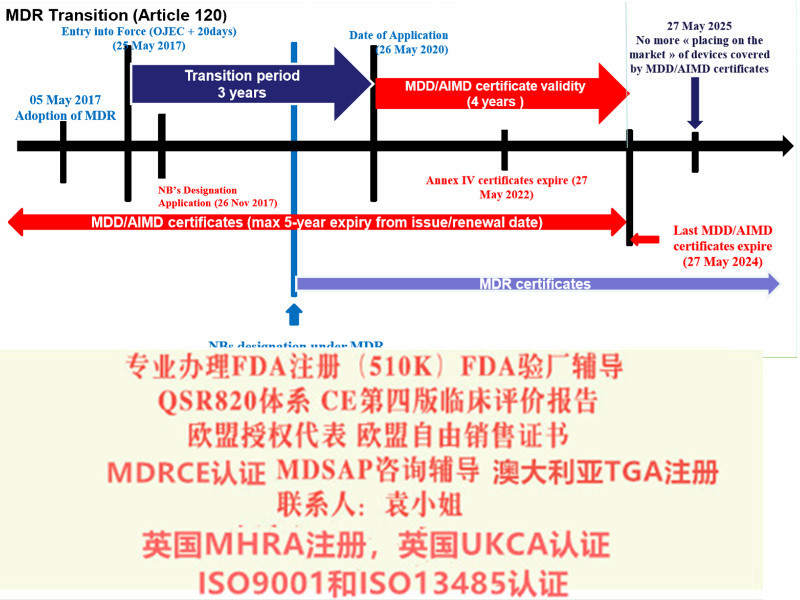
MDR对于DOC的要求
MDR 在其附录 IV中对DOC的内容作了明确的规定,至少包括如下内容:
制造商名称、注册商品名或注册商标和单一注册号(如签发)及其授权欧盟代表(如适用)和注册营业地点的联系
制造商对签发欧盟符合性声明负完全责任的声明
附录VI第C部分所所述的基本的器械标识UDI - DI
产品名称和商品名、产品代码、目录编号或欧盟符合性声明中包含的其他允许识别和追溯产品的明确的参考号,如适当照片,以及适当时其预期目的。除产品或商品名称外,第3条中基本UDI – DI所提供的允许识别和可追溯产品的信息
按照附录VIII的规则所划分的器械风险等级
当前声明所涵盖的器械符合本法规,以及适用时其他相关的要求签署欧盟符合性声明的欧盟立法的声明
符合性声明中所用的任何通用规范的索引
公告机构的名称和标识号(如适用),所执行的符合性评估程序的说明和所签发的证的标识
如适用,额外的信息
签字人的声明,和日期、签字人姓名和职务、以及代签人签名
按照MDR的附录VIII划分为普通I类的产品(非灭菌、非重复使用、无测量功能的I类产品)*公告机构介入,制造商可以进行自我符合性声明。在这种情况下,DOC的内容与上面所述的公告机构介入的情况有所不同,比如公告机构的名称和标识号就不适用。
对于需要公告机构介入的器械,符合性声明的签署通常是符合性评定程序的后一步。在未取得公告机构签发的CE证之前,制造商无法签署正式的DOC文件。不过制造商可以先起草一份DOC的草案提供给公告机构审查。而对于*公告机构介入的器械,制造商在法规所要求的产品符合基本要求的证据准备充分后,即可签署DOC。
DOC作为法规要求的重要文件,制造商应该按照质量管理体系中文件控制程序的要求进行管控。DOC中任何内容发生了变更,则需重新签发。特别需要注意的是,对于由公告机构发证的产品,DOC中任何内容的变更,都需得到原发证公告机构的评审和批准。

SUNGO SUNGO Europe B.V. 总部位于荷兰,提供技术服务。主要业务是根据欧洲立法和国际标准,为客户提供完整的技术解决方案。SUNGO集团凭借**网络和队伍为**客户提供法规,在器械行业尤为专长。提供欧盟授权代表服务,可以为客户减少中间环节,节约时间和费用,使您的产品在符合现行欧盟法规的情况下进入市场的程序简单化。
SUNGO SUNGO Europe B.V.作为欧盟代表是被荷兰国家局局认可的。可以帮企业到欧盟主管注册,以免进入海关时出问题和引起法律纠纷,造成不必要的经济损失。
欧盟国家出具的自由销售,目前针对器械做的比较多的是欧盟成员国的局出具的自由销售。

Class III,IV:
1. 通过CMDCAS认可的认证机构进行ISO 13485 审核认证(体系审核除ISO13485要求外还要包括CMDR的要求),获得证。
2. 准备Canadian Medical Device License (MDL)申请。
3. 提交MDL申请和Premarket review documents,并交纳行政收费。
4. Health Canada评审MDL申请和Premarket review documents, 评审通过后进行网站公示。
需要准备的文件清单
I类器械豁免注册。II,III,IV类器械的注册要求如下:
1. 通用注册资料:
a) 器械的名称;
b) 器械的分类
c) 器械的标识;
d) 产品标签上出现的制造者名称、;
e) 若制造地点与
f) 不同,则制造地名称、;
2. II 类器械注册附加资料:
a) 所制造、销售或代理的器械关于条件的目的及用途的描述;
b) 为满足*和有效性要求所符合的标准的清单;
c) 由制造者的高层主管作的*有效性符合声明;
d) 由制造者的高层主管作的器械标签符合加拿大器械法规的声明;
e) 若是近病人体外诊断设备(即不在而是在例如家庭使用的设备),制造者的高层主管应声明已用代表预期使用者的人体物质在与预期使用条件类似的条件下进行了研究性测试;

加拿大的管理实行产品注册制度。
不同于美国食品管理局(FDA)彻底管制,由对产品注册管理,再由的现场审(GMP审查),亦不同于欧洲的完全第三方公告机构(Notified Body)检查制度(CE 认证),加拿大实行注册结合第三方的质量体系审查。这里所说的第三方,指经加拿大标准会(SCC) 所认可的能够进行加拿大器械合格评定体系(CMDCAS, Canadian Medical Devices Conformity) 审核的第三方机构。
CMDCAS注册及分类
依据Canadian Medical Devices Regulations (CMDR) SOR/98-282 as published by Health Canada.根据器械的使用风险将器械分为I, II,III,IV四个分类,如I类器械为风险,IV类器械风险为。为此针对制造者提出的产品注册要求也是逐级增加,要求制造者实行的体系是愈加详尽。
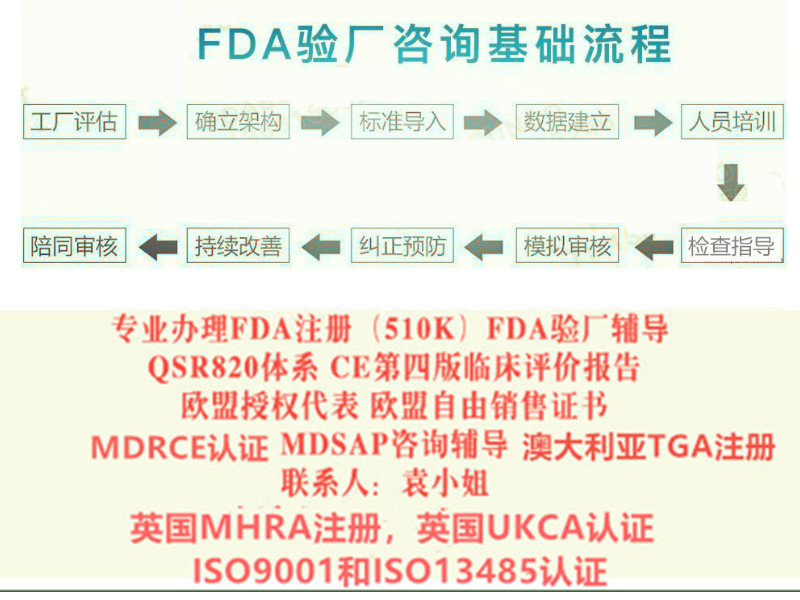
注册的基本流程介绍如下:
SUNGO将秉承一贯“服务、客户”的原则,依托的技术团队,优化我们的服务,让更多的器械合法、*进入市场,为器械行业健康发展贡献力量。
http://sungofda.cn.b2b168.com