周期4周
国家瑞士
有效期1年
费用来电面议
认项目瑞士代表
瑞士也已经不认可欧洲的CE认,您有产品出口瑞士吗?是否有做瑞士代表以及瑞士注册的?
1:手术衣510K,隔离衣510K,手套510K,电动/手动轮椅510K,FDA注册,FDA美国代理人
2:ISO13485认,CE评估报告编写,FDAQSR820等产品出口的相关认
如果制造商不在欧盟或欧洲经济区内,同时又没有在2021年5月26日之前欧盟授权代表的制造商,应在2021年5月26日或者进行瑞士器械贸易时瑞士代表。

瑞士代表的报价原则:
瑞士代表的报价主要基于产品风险分类以及数量多少来决定,同单位数量下产品风险越高瑞代费用越高,同等风险分类下产品数量越多瑞代费用越高。
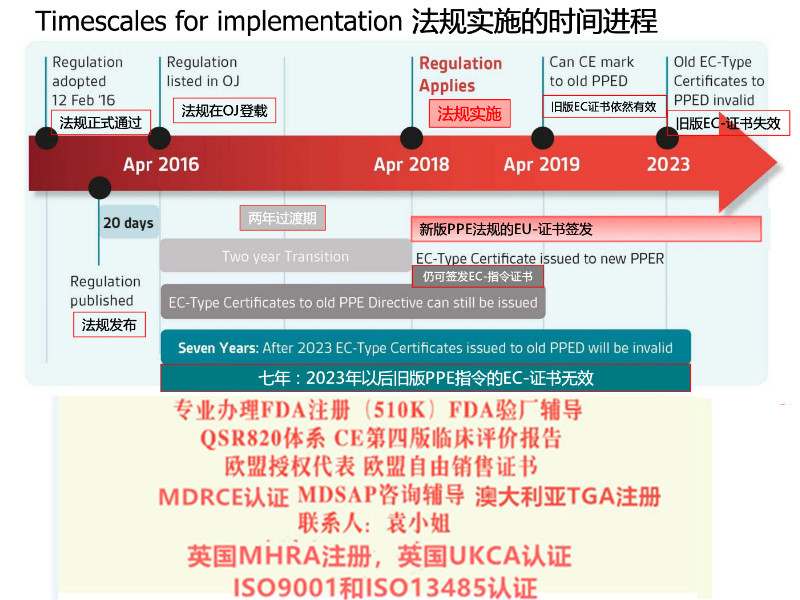
在2021年5月26日之前,非欧盟向瑞士出口器械时,需要欧盟授权代表可以满足要求。
但是从2021年5月26日之后,出口瑞士需要单瑞士代表(CH-REP)。
PART1什么是瑞士代表?
瑞士代表的定义:任何在瑞士境内成立的自然人或法人已收到并接受位于瑞士的制造商的书面授权,以代表制造商其在器械条例下的义务的特定任务采取行动。
为了能够履行必要的职责,瑞士代表应其法规负责人PRRC。同时瑞士代表应确保具备充分的知识以应对器械上市前和上市后的各项工作
另外,按照瑞士法规要求,瑞士代表也需要在对瑞士的器械贸易发生后的三个月内完成其CHRN的注册。

协助判定产品分类
1) I类器械:通常是指不接触人体或只接触完整皮肤的器械。
2) I-m(测量)器械:带有测量功能的I类器械。
3) I-s()器械:终以形式出现在市场上的I类器械。
4) IIa类器械:风险等级较一类器械高,一般是指暂时使用的侵入器械等,有能量交换或测量的有源器械。
5) IIb类器械:风险等级较高,一般指会对人体有潜在风险或者是长时间使用。
6) III类器械:风险等级,一般用于人体循环系统或大脑。
补充:瑞士立后,目前的法规在器械上更趋近于欧盟的MDR法规,而在体外诊断器械上的要求更趋近于IVDD法规的要求。。
中国制造商要将器械投入瑞士市场,需要清晰了解瑞士器械的法规要求,进行充分准备,以确保程序符合规范要求。
http://sungofda.cn.b2b168.com









