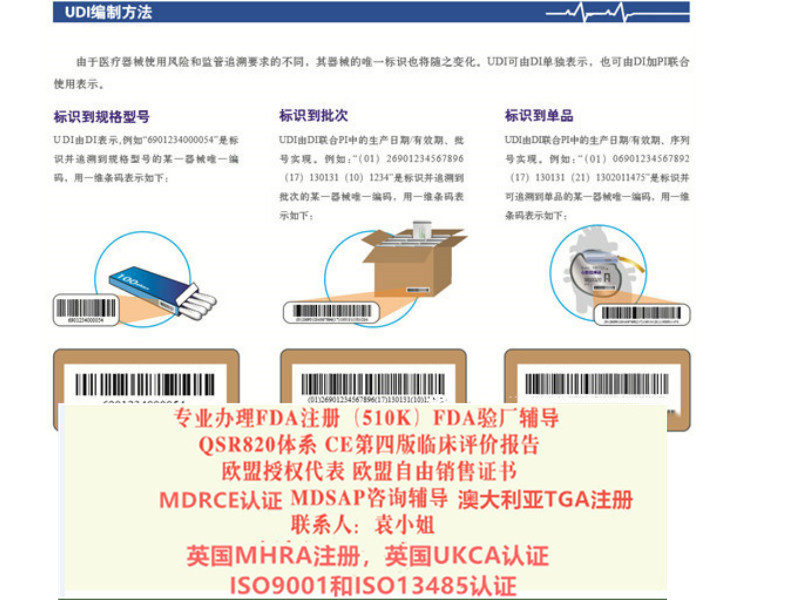
周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
我公司办理:ISO13485认证,CE评估报告编写 等产品出口的相关认证
目前急需做CE认证的客户很多,检测认证公司,代理公司也是鱼目混
杂,参差不齐。
怎么辨别口罩CE认证的真假呢?
1,凡是说3、5两千可以出CE证的都是
2,凡是说3/2天可以*的都是
3,凡是说国内公司自己可以发CE证的都是
辨别证的真伪很重要,因为一旦货到了港口清不了关损失就大了。
所以不要贪图*和快而上当受
NB号的CE证。按照现行的欧盟器械法规,此路径获取CE证的
时间至少8个月以上,费用比较昂贵。
欧盟I类器械,如果是非灭菌产品,具体分类为I类。按照指令要求,
公告机构不可强制介入I类器械的发证事宜,制造商可以基于完整的CE技
术文档宣称符合CE(自我CE符合性声明格式如下)。也即,制造商不需
要找发证机构去申请带NB号的CE证,制造商根据自己出具自我CE符
合性声即可打上CE mark,出口欧盟。在欧盟有经销活动前,需要委托
欧盟授权代表去当地主管机构做欧盟注册,整个欧盟28个成员国,只需
登记一次。整个周期是1-4周。
---签订欧盟代表协议---起草I类器械的MDR CE技术文档---欧盟注册---
签发DOC。
这种途径符合CE的标志,就是完成如上四步,终生效的DOC是没有公
告号的。
建议企业同步建立ISO 13485器械质量体系,产品需要满足的检测
要求(比如口罩的EN14683产品性能检测;ISO 10993生物相容性检
测,还是要满足)。产品市场后的监督工作还是要有计划做。
另外,外销产品随附的文件,如说明书、标签都是要符合欧盟相关
器械标准要求EN ISO 15223 & EN 1041。
现在市面上所有发的设计精美,各式各样的所谓的发证机构发出的证
书,费用在1-2万,周期几天的,这种证,其实只是精装的DOC,如
果没有有效的欧代协议+TCF技术文档+欧盟注册作为支撑,这种证是
没有支撑证据的,也即没有真实的作用。
出口非欧盟为: 国外的客户,想要进口中国工厂的产品,需要客户,先要把产品在当地的局进行注册,完成注册后,才可以进口,销售。

什么是510(k) FDA510(k)即上市前通告PMN(Pre-market Notification),旨在该产品与已经合法上市的产品实质性等同(Substantially Equivalent)。因其描述在食品、药品和化妆品法案(FD&C Act)的第510(k),故通常称作510(k)。大部分的II类器械,以及少量的I类和III类器械在上市前都需要向FDA提交510(k)申请。
MDR 第17 条规定,一次性使用的器械的复用只能在相应法律允许的情况下进行,且应符合MDR 的规定。任何对一次性使用器械的再处理即复用的自然人或法人应视为复用器械的制造商,承担制造商义务,包括器械的可追溯性。但目前只有部分欧盟成员国接受器械复用并具备相应的法规规定。
对制造商和产品的影响而言,93/42 EEC指令和MDR基本上具有相同的基本要求。没有现有的需求,但是MDR添加了新的需求,与目前93/42指令相比,MDR更加强调生命周期方法的性,并有数据支持。MDR对公告机构的提出了更严格的要求,对主管当局和会加强了控制和监测。
http://sungofda.cn.b2b168.com









