气管切开插管MDR的CE第四版临床评价报告 医疗器械临床评估报告 申请条件
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
品牌SUNGO
公司SUNGO
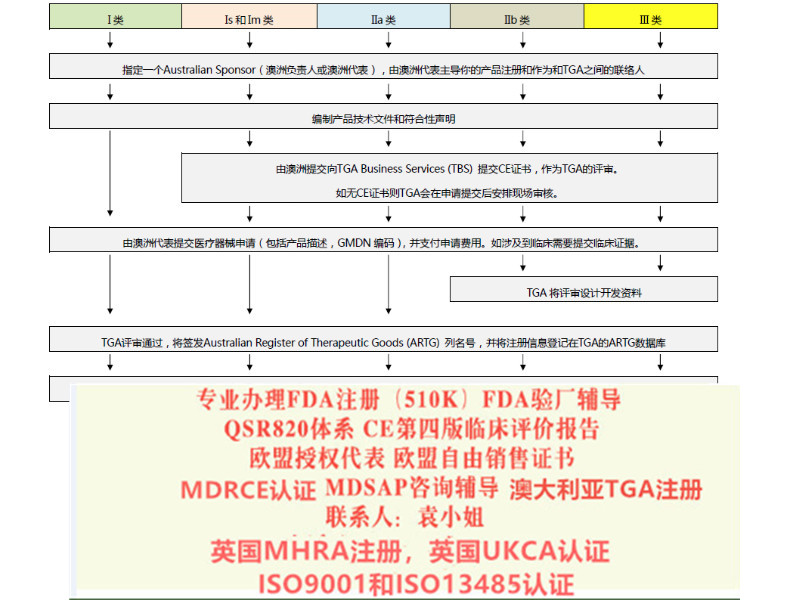
流程SUNGO
国家欧洲
个人防护类防护服:非医用防护服可以按照个人防护用品出口到欧盟,需要满足(EU)2016/425(PPE)指令。PPE将个人防护产品分为I类、II类、III类产品。
对于需要公告机构介入的器械,符合性声明的签署通常是符合性评定程序的一步。在未取得公告机构签发的CE证书之前,制造商无法签署正式的DOC文件。不过制造商可以先起草一份DOC的草案提供给公告机构审查。而对于*公告机构介入的器械,制造商在法规所要求的产品符合基本要求的证据准备充分后,即可签署DOC。 DOC作为法规要求的重要文件,制造商应该按照质量管理体系中文件控制程序的要求进行管控。DOC中任何内容发生了变更,则需重新签发。特别需要注意的是,对于由公告机构发证的产品,DOC中任何内容的变更,都需得到原发证公告机构的评审和批准。
企业准备UKCA合格评定注意事项 从目前公告机构的安排来看,部分位于英国的原公告机构已经准备了认证证书转换方案。这类机构会自动获得UKCA认证机构的。通常如果持有该机构原签发的CE证书可以进行转换,同时也受理原先持有欧盟其他公告机构的CE证书的客户的转换申请。

欧盟三个器械指令:
在器械领域,欧盟会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。
这三个指令分别是:
1.有源植入性器械指令(AIMDD, 90/385/EEC),适用于心脏起搏器、可植入的泵等有源植入性器械。AIMDD于1993年1月1日生效。过渡截止期为1994年12月31日,从1995年1月1日起强制实施。
2.体外诊断器械指令(IVDD,98/79/EC),适用于诊断试剂、血糖仪、检测装置等体外诊断用器械。
3.器械指令(MDD,93/42/EEC),适用范围广,包括除有源植入性器械和体外诊断器械之外的几乎所有器械产品,如无源性器械(伤口敷料、一次性使用无菌器、、、导管等)、有源器械(如MRI核磁共振检查仪、超声诊断仪、输液泵、X射线机、电子血压计等)及植入性器械(接骨钢板、螺钉、关节假体等)。该指令已于1995年1月1日生效,过渡截止日期为1998年6月13日,从1998年6月14日起强制执行。
上述指令规定,在指令正式实施后,只有带有CE标志的器械产品才能在欧盟市场通销售。

通过豁免指令的形式上市,且符合新法规的器械可在2020 年5 月26 日之前投放市场。并可在2020 年5 月26 日前并通知符合新法规的符合性评估机构。公告机构可在2020 年5 月26 日前, 采用合规的符合性评估流程并按照新法规签发。
我们的核心资源包括分布在**主要经济体的运营网络,具有美国IAS认可资质的实验室,具有ANAB认可资质的认证机构,以及分布**的资源。依靠这些资源,我们为**的器械生产商和经营者提品全生命周期的市场准入服务。
http://sungofda.cn.b2b168.com









