护具的MDR CEMDR EU 2017-745认证 ouc认证 eu2016/425标准
更新时间:2024-10-30 浏览数:1
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
MDR新法规将建立一个健全,透明,可持续的框架,得到国际认可,可提高*性并为制造商创造公平的市场准入。与指令不同,法规不需要转变为国家法。
-他们在那里的设备,无访问该设备的既不样品,传送到制造商从任何请求MHRA提供此类样本或访问,并传达给MHRA制造商是否打算遵从该请求 -与MHRA合作,采取任何预防或纠正措施,以或(如果不可能)减轻设备带来的风险 -立即告知制造商有关人员,患者和用户的投诉以及有关与其被任命的设备有关的可疑问题的报告 -如果制造商的行为违反了本法规规定的义务: -终止与制造商的法律关系;和 -将该终止通知MHRA和相关的批准机构。 -进口商或分销商有可能担任英国负责人。

市场监督,警报,经济运营和设备登记的规定。可通过免税订单获得,符合新规定的设备可在2020年5月26日前投放市场。符合新规定的合格评定机构可在2020年5月26日前并通知。可以采用合规合规评估程序,并在2020年5月26日之前根据新规定颁发证书。
符合性声明中所用的任何通用规范的索引 公告机构的名称和标识号(如适用),所执行的符合性评估程序的说明和所签发的证书的标识 如适用,额外的信息 签字人的声明,地址和日期、签字人姓名和职务、以及代签人签名
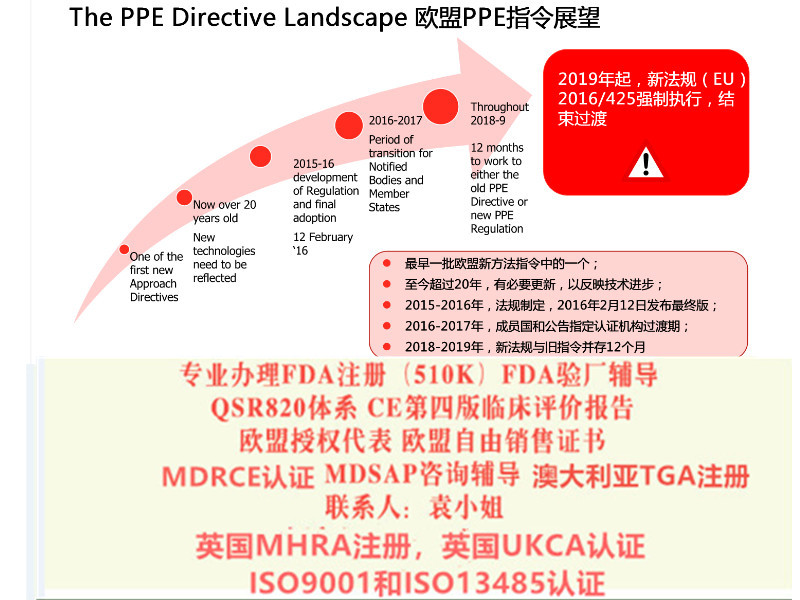
对于特定Ⅲ类器械和Ⅱ b 类器械产品,在已委派必要的器械协调小组(MDCG)、小组前提下,同样可通过指令豁免在2020 年5 月26 日之前投放市场。 法规关于公告机构的要求(正文第35~50 条) 自2017 年11 月26日起适用,即公告机构在新法规发布后的六个月内即应开始进行相应的申请,符合要求后方可依据新法规开展符合性评估。 同时法规对成员国主管机构的和MDCG 的成立也设定了期限,要求于2017 年11 月26 日前完成。对于成员国主管机构之间的协调,设定期限为2018 年5 月26 日。
瑞士也已经不认可欧洲的CE认证,您有产品出口瑞士吗?是否有做瑞士代表以及瑞士注册的?
http://sungofda.cn.b2b168.com