周期4周
品牌SUNGO
公司SUNGO
流程SUNGO
国家欧洲
我们为企业编写的MDR CE技术文件里的:风险分析报告,评价报告,基本基本检查表等等,不仅仅是为了获得一张证书而做的,更多的都是从各个方面来产品是的有效的。
法规条款增加,认证评审更加严格
法规条款增加,认证评审更加严格,分类规则增加:由MDD的18条增加到 22条;
我公司办理产品出口欧盟、美国、中东南美等的各种认证:
TUV莱茵,TUV南德,***等CE认证,CE技术文件编订, CE第四版评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改,英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。
关于CE新版评价报告MEDDEV 2.7.1的编写流程
法规背景
2016年6月,欧盟会(European Commission)发布了第四版器械评价的原则(MEDDEV 2.7.1 Rev.4)。和2009年第三版的原则相比,直观的变化是文件的页数从46页变为了65页,更新的版本不仅包含了新的要求,还有对以前要求的进一步细化,扩展和澄清,同时还有一些举例以帮助生产商实施评价
MEDDEV2.7/1从性质上来说是一份原则,所以它没有所谓的“生效日期”,由每一个公告机构自行决定第三版的失效日期及第四版的实施日期。目前大多数的公告机构如TUV南德(NB 0123)已经不再接受基于第三版原则的评价报告;之前按照第三版完成评价获得CE证书的产品也会在监督审核的时候被要求按照第四版进行补充评价即更新撰写。
此外,该原则的发布时间碰巧在2016年6月15日MDR(草稿)文本发布之后,所以原则的要求也与新法规的评价的要求较为接近。所以该原则也可以作为向新法规过渡的一个工具。
ce第四版评价报告
2. MEDDEV 2.7.1 Rev4主要变化
2.1主要变化之一:报告更新的频率
按照新版报告指南的要求,对于高风险或者新设备,应每年更新;对于低风险的设备,每2‐5年更新。对于如何确定更新的额频率需要有定义。对于任何风险类别的器械,如果从PMS收集到的信息影响到评价或者结论,CER需要进行更新。
2.2主要变化之二:报告编写人和评价人的资质
按照新版报告指南的要求,对于报告的编写人提出了资质要求。包括需要有相关的高等教育学位以及至少五年的经历,或者十年的工作经历,如果学位不够的话。如果不能满足要求,需要对其资质进行判定和说明。
2.3 主要变化之三:评价报告需要有明确的可测量的目标
第四版评估指南对于评估报告的目的有更明确的描述,需要与器械的性、性能以及风险‐收益平衡进行更加清晰和详细的描述,在指南的第7部分和附件5中有详细的描述。
2.4主要变化之四:确定技术发展水平
第四版评估指南对于设备的技术发展水平和处理方式的建立和文件化,提供了更加详细的描述。这包括确定设备的性和性能,以及被宣称的比对器械,行业的基准器械,或者其他的类似器械;需要包括风险和收益的分析。
2.5 主要变化之五:数据的科学性和有效性
第四版评估指南非常强调数据的科学性和有效性,包括从统计学考虑。这贯穿于整个指南文件规定的阶段,包括影响数据完整性的因素,数据的客观性和权重,文件搜集的方法,数据的评估和权重,数据是否阐述了符合性的分析。
2.6 主要变化之六:比对器械
第四版评估指南对于评估器械和比对器械的等效有了更加详细的规定,特别强调对于比对器械的数据的可获得性。需要从数据、技术参数、生物性能三个方面逐一比对,确保所有比对的内容不存在差异。
2.7 主要变化之七:比对器械的数据获得
第四版评估指南要求公告机构对于企业是否能够获得比对器械的数据进行挑战,这个被认为是法规的一个转折点,这要求制造商需要有一个被允许接触竞争对手的器械数据的协议。
2.8 主要变化之八:什么时候需要试验
第四版评估指南附件2详细描述了器械的风险以及制造商怎么决定是否具备了充分的证据。
ce第四版评价报告
2.9 主要变化之九:风险‐收益
附件7提供了详细的指南,对于器械的性和性能表述;
附件7.2讨论了风险和收益分析,包括对于风险和收益的量的评估,以及总体评价。交付后的数据价值,以及可能会影响统计有效性行的因素等。
2.10 主要变化之十:售后监督和售后跟踪
第四版指南强调了评估、售后监督和售后评估的关系。
附录12强调了公告 机构需要确认PMCF被很好的策划了,以及依据所收到的数据来描述其满足CER。

办理出口:美国FDA注册(含FDA510K申请)、 FDA QSR820验厂及整改、FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改、CE认证(CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016、欧盟授权代表、欧盟自由销售证书、英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。

如何选择EAR EAR并非特定授予的资质或认可,没有第三方评价资质可以参考。任何一个能够履行欧盟法规特定职责的欧盟成员国境内自然人或法人都能够成为EAR。但EAR不仅仅是提供了一个欧洲境内的注册地和响应代表,合格的EAR还应当: 1)具有的法规和法律能力,帮助企业咨询、了解并响应欧盟法规; 2)合法的帮助制造商在欧盟境内注册相应设备和器械; 3)有充足的技术能力验证并评审企业技术文件,实施内部评审,降低质量风险; 4)具有一个良好的公共关系纽带,有丰富的经验帮助制造商与欧盟有关部门沟通并解决问题; 5)跟进法规更新,了解熟悉MDR,清晰识别EAR职责,有能力确保制造商符合要求。 [img/new19/sungo99/1596099175.jpg[/img] 出于节约成本的考虑,制造商自己的进口商或贸易律师等都可以是EAR的选择之一。为了更好地符合欧盟要求以及减少风险,也可选择的EAR代理机构。充分考察EAR的沟通能力、响应时效、信息准确性、规模和、行业口碑等,是选择合格EAR的重要依据。
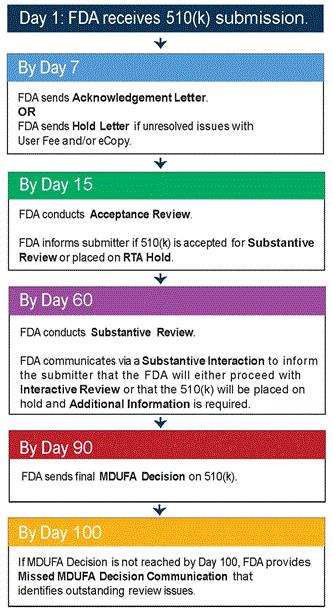
经济运营者是指制造商,授权代表,进口商,分销商以及系统或手术袋的任何组合或。投放市场的自然人或法人。也是说,负责按照法规生产设备(包括组合或),销售和上市后操作的自然人或法人2017 年4 月5 日,欧洲议会和理事会正式签发了欧盟关于器械第2017/745 号法规(MDR,EU2017/745),5月5日,欧盟(Official Journal of the EuropeanUnion) 正式发布该法规。
SUNGO公司介绍:SUNGO创建于2006年。以助力大健康产品**流通为使命,我们致力于成为受用户信赖的合规服务机构。SUNGO的客户覆盖**洲,遍布30多个和地区,客户总数**过5000家。、、中国器械企业**过30%选择SUNGO,同时也有多家**器械企业选择SUNGO提供服务。
http://sungofda.cn.b2b168.com









