护膝的MDR CEMDR EU 2017-745认证 ENEC认证 ga745 2017标准
更新时间:2024-11-17 浏览数:2
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
器械法规(MDR)的背景
MDR将取代现有的器械指令(93/42/EEC)(MDD)和主动植入式器械指令(90/385/EEC) (AIMDD)。MDR于2017年5月发布,标志着MDD和AIMDD之间为期三年的过渡期的开始。
在过渡期间,MDR将逐步生效,首先是与公告机构和制造商根据MDR申请新证的能力有关的规定。
过渡期将于2020年5月26日,即MDR法规的“适用日期”(DoA)结束。从那时起,MDR将完全适用。
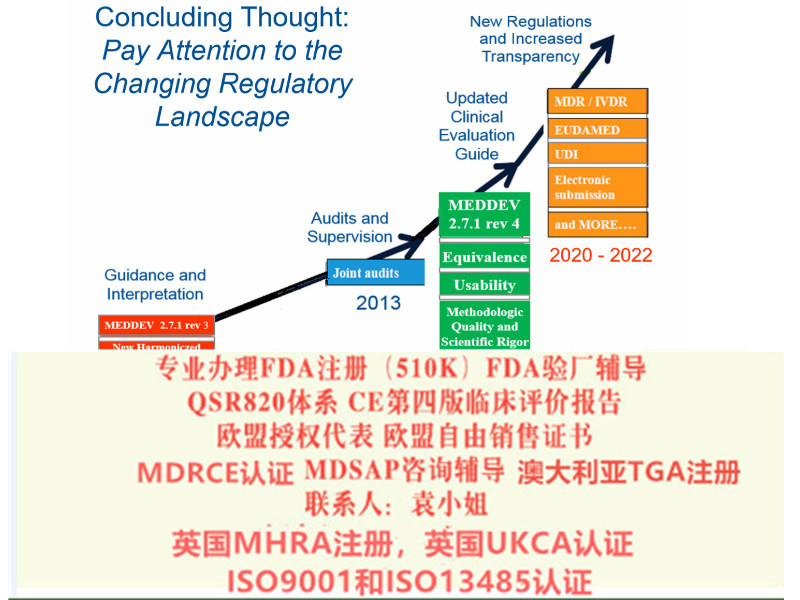
MDR 在很多方面的规定都趋于更加严格的模式,更加强调持续和协作的方式。如从层面自上而下确定了欧盟、各成员国、公告机构、经济运营商各自的义务和责任,同时从法规层面设定了成员国之间、公告机构之间及制造商与部门之间沟通和协作的制度及途径,从产品角度来讲,从产品生产质量体系建立和实施、符合性评估过程中的通用基本要求、技术文件建立、上市后文件建立、证据等上市前要求,到符合性评估程序要求,以及上市后、警戒和市场等措施,覆盖产品生命周期的全过程,并规定了信息管理的具体要求,包括UDI 及市场的电子系统等。

MDR欧盟授权代表和MDD欧盟授权代表的区别: 欧盟授权代表(AR)是指在欧盟境内的任何自然人或法人,其收到并接受位于欧盟以外的制造商的书面授权,代表该制造商按照本法规对制造商所规定的义务要求所进行的一切行动。 需要办理以下认证可以随时找我 : 1:出口欧盟:MDR CE认证/IVDRCE认证,欧盟授权代表,欧盟注册,欧盟自由销售证书 2:出口英国:英国代表,英国MHRA注册,UKCA认证,英国自由销售证书 3:出口美国:美国FDA注册,FDA510K,QSR820体系 4:中国:国内的器械注册证和生产许可证 5:出口加拿大:加拿大的MDEL注册 6:质量管理体系认证:ISO13485咨询和认证

SUNGO作为**化的器械法规技术服务商,可提供服务: 1. 确定您的器械在美国的具体分类及风险级别; 2. 企业准备510(k)申请所需的资料; 3. 确定检测标准及适用项目,推荐测试机构,对检测报告进行审查; 4. 编撰510(k)申报文件; 5. 企业进行小企业资质申请; 6. 跟踪510(k)文件评审进度; 7. 企业整改发补问题; 8. 进行企业注册和产品列名。
MDRCE认证,CEMDR认证,编写CE技术文件,CE第四版评价报告,(MDRCE技术文件:Medical Device Regulation 2017/745/EU) 我公司是做: 新MDR法规和MDD指令的欧盟CE认证,CE第四版评价报告更新/编写 欧盟自由销售证书,欧盟授权代表(德国,荷兰,英国), ISO9001/ISO13485认证以及咨询 FDA注册,FDA510K,FDA验厂/陪审和翻译 MDSAP咨询,国内注册证,生产许可证的办理
我们可以为您提供的自主服务项目主要有: 出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE第四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售、防护服PPE指令Type5/6认证 出口美国法规:器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系、食品FDA验厂及整改、OTCFDA验厂及整改 中国法规:器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证、SFDA验厂、SFDA注册检测、企业标准编制、局自由销售证。
http://sungofda.cn.b2b168.com









