产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
如果制造商在欧洲没有实际的场地,需要任命一位欧洲授权代表,代表制造商在欧盟境内进行相关的法规联络事宜。
英国的法规是:英国法律(UK MDR 2002)(相当于欧盟的MDD/IVDD指令)
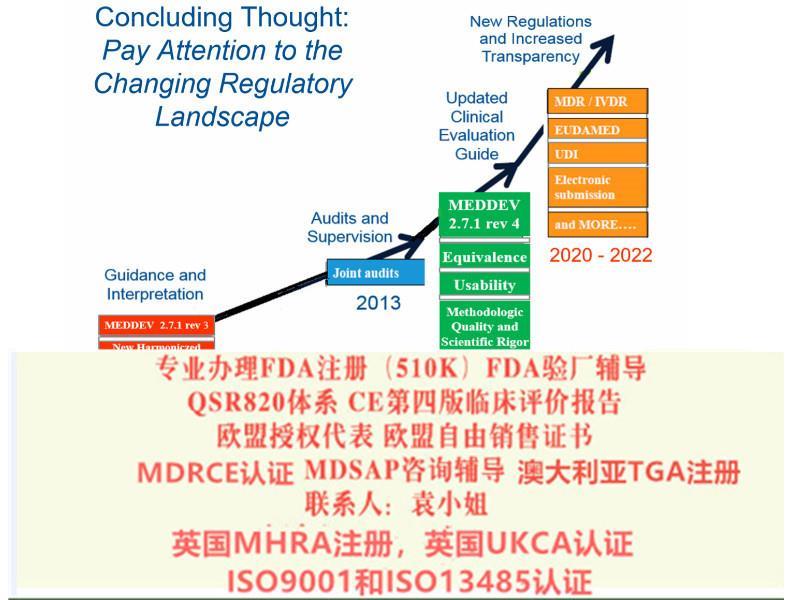
需要办理以下认证可以随时找我 :
1:出口欧盟:MDR CE认证/IVDRCE认证,欧盟授权代表,欧盟注册,欧盟自由销售证书
2:出口英国:英国代表,英国MHRA注册,UKCA认证,英国自由销售证书
3:出口美国:美国FDA注册,FDA510K,QSR820体系
4:中国:国内的器械注册证和生产许可证
5:出口加拿大:加拿大的MDEL注册
6:质量管理体系认证:ISO13485咨询和认证
对于特定Ⅲ类器械和Ⅱ b 类器械产品,在已委派必要的器械协调小组(MDCG)、小组前提下,同样可通过指令豁免在2020 年5 月26 日之前投放市场。
法规关于公告机构的要求(正文第35~50 条) 自2017 年11 月26日起适用,即公告机构在新法规发布后的六个月内即应开始进行相应的申请,符合要求后方可依据新法规开展符合性评估。
同时法规对成员国主管机构的和MDCG 的成立也设定了期限,要求于2017 年11 月26 日前完成。对于成员国主管机构之间的协调,设定期限为2018 年5 月26 日。

通过豁免指令的形式上市,且符合新法规的器械可在2020 年5 月26 日之前投放市场。并可在2020 年5 月26 日前并通知符合新法规的符合性评估机构。公告机构可在2020 年5 月26 日前, 采用合规的符合性评估流程并按照新法规签发。

管理条例规定的职责和具体内容
1)代表制造商;
2)应要求向主管当局提供制造商授权委托其为EAR的副本;
3)验证制造商起草的欧盟符合性声明和技术文件;
4)在适用的情况下,验证制造商是否已执行适当的合格评定程序;
5)保留一份技术文件、符合性声明的副本,如果适用,还应保留一份相关证书的副本,供主管当局使用;
6)遵守注册义务;
7)验证制造商设备注册所需承担义务的符合性;
8)应要求向主管当局提供必要的信息和文件,以设备的一致性;
9)向制造商发送主管当局对样品或设备访问的任何请求,并验证主管当局是否收到样品或获得设备访问权限;
10)与主管当局合作,采取任何预防或纠正措施,以或减轻设备造成的风险;
11)向制造商通报人员、患者和用户对其设备相关疑似事件的投诉和报告;
12)应在与制造商相同的基础上对有缺陷的设备承担法律责任,并与制造商承担连带责任。
[img/new19/sungo99/1565589799.jpg[/img]
(三)如何选择EAR
能为客户在欧盟境内销售产品时出现任何问题给予及时的信息沟通与协助解决。
http://sungofda.cn.b2b168.com









