护膝的MDR CEMDR EU 2017-745认证 eac认证 ga745 2017标准
更新时间:2024-07-04 浏览数:1
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
欧代和注册服务SUNGO 荷兰和德国公司可以提供欧盟授权代表服务,同时提供向当地部门申报注册的服务。
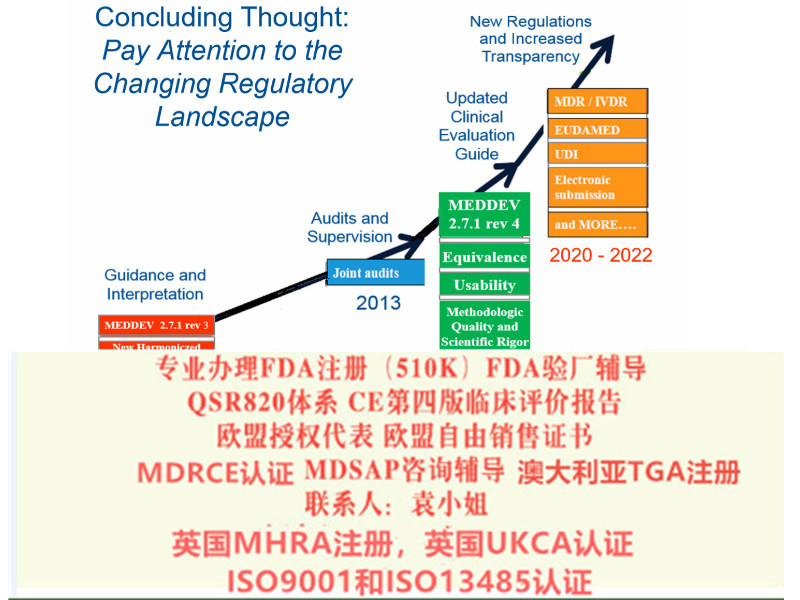
至2020年5月26日,MDR法规将强制实施。至2022年5月26日IVDR法规将强制实施。至2014年,MDD/ AIMD证书全部失效。MDR新法规变化1)扩大了应用范围2)提出了新的概念和器械的定义3)细化了器械的分类4)完善了器械的通用和性能要求5)加强对技术文件的要求6)加强器械上市后的7)完善评价相关要求事故对于患者意味着伤害,对于企业的生存也具有巨大的破坏力。因此,评估的设计和数据的收集具有至关重要的意义。然而在实践中,许多制造商不清楚什么是欧盟法规所要求的评估,什么样的数据能满足欧盟的法规要求。

MDRCE认证,CEMDR认证,编写CE技术文件,CE第四版评价报告,(MDRCE技术文件:Medical Device Regulation 2017/745/EU)
近两年,欧盟加强了评价和上市后监督的要求。2016年7月,器械评估的全新文件MEDDEV 2.7/1第4版在欧盟会网站上正式发布。该指南明确了现有的一些要求,对于制造商如何进行一个健全、系统的评价,以及如何数据和结论的科学有效性有了更明确的。这也给制造商带来了新的挑战。
通过更换现行的器械指令(MDD)93/42/ EEC,该新法规将从2020年开始有效。MDR的过渡期MDR法规是2017年发布的,那对于厂家来说,我们还有多长时间来准备呢?
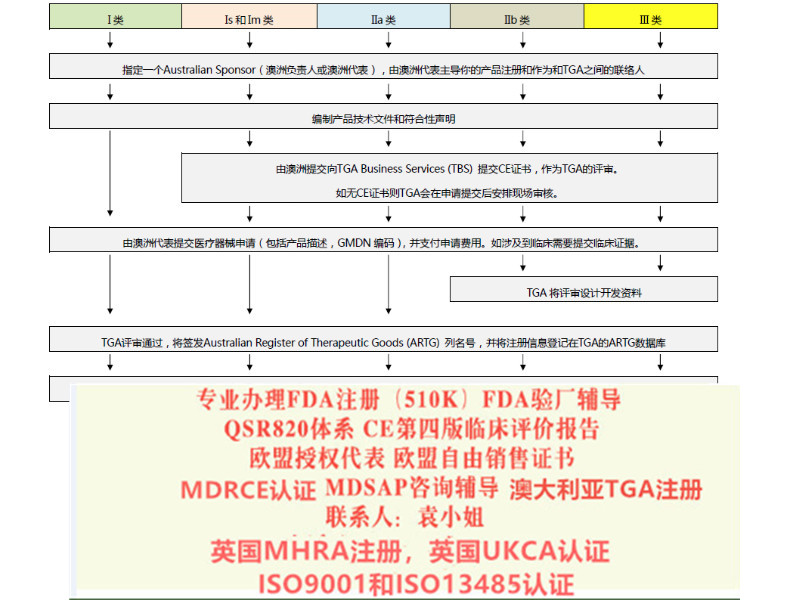
我公司办理:出口瑞士:需要瑞士代表,瑞士注册
http://sungofda.cn.b2b168.com