电动病床的MDR CEEU 2017-745认证 EU 2017/745的适用规则 完整版
更新时间:2024-07-02 浏览数:2
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
随着MDR(EU 2017/745)法规的实施,欧盟市场对器械的要求越来越高。对于出口量较大的防疫物资——防护服、隔离衣、手术衣,企业有必要了解下各产品出口欧盟需遵循的合规程序。
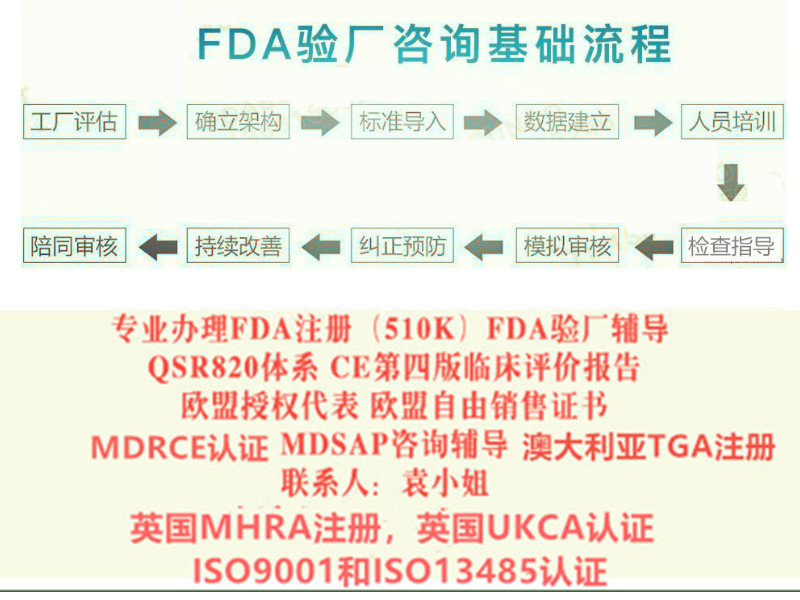
出口美国需要的为: FDA注册,FDA510K,QSR820体系(美国FDA验厂) 出口非欧盟为: 国外的客户,想要进口中国工厂的产品,需要客户,先要把产品在当地的局进行注册,完成注册后,才可以进口,销售。
至2020年5月26日,MDR法规将强制实施。至2022年5月26日IVDR法规将强制实施。至2014年,MDD/ AIMD证书全部失效。MDR新法规变化1)扩大了应用范围2)提出了新的概念和器械的定义3)细化了器械的分类4)完善了器械的通用和性能要求5)加强对技术文件的要求6)加强器械上市后的7)完善评价相关要求事故对于患者意味着伤害,对于企业的生存也具有巨大的破坏力。因此,评估的设计和数据的收集具有至关重要的意义。然而在实践中,许多制造商不清楚什么是欧盟法规所要求的评估,什么样的数据能满足欧盟的法规要求。

MDRCE认证,CEMDR认证,编写CE技术文件,CE第四版评价报告,(MDRCE技术文件:Medical Device Regulation 2017/745/EU) 我公司是做: 新MDR法规和MDD指令的欧盟CE认证,CE第四版评价报告更新/编写 欧盟自由销售证书,欧盟授权代表(德国,荷兰,英国), ISO9001/ISO13485认证以及咨询 FDA注册,FDA510K,FDA验厂/陪审和翻译 MDSAP咨询,国内注册证,生产许可证的办理

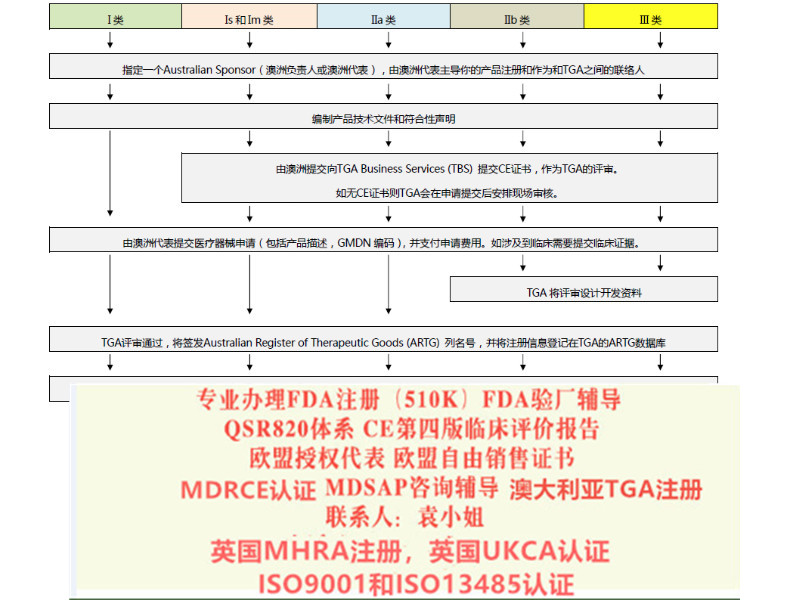
需要办理以下认证可以随时找我 : 1:出口欧盟:MDR CE认证/IVDRCE认证,欧盟授权代表,欧盟注册,欧盟自由销售证书 2:出口英国:英国代表,英国MHRA注册,UKCA认证,英国自由销售证书 3:出口美国:美国FDA注册,FDA510K,QSR820体系 4:中国:国内的器械注册证和生产许可证 5:出口加拿大:加拿大的MDEL注册 6:质量管理体系认证:ISO13485咨询和认证
SUNGO SUNGO Europe B.V.作为欧盟代表是被荷兰国家局局认可的。可以帮企业到欧盟主管注册,以免进入海关时出问题和引起法律纠纷,造成不必要的经济损失。
http://sungofda.cn.b2b168.com