血液回路编写CE第四版临床评价报告 MEDDEV2.7.1 Rev 4编写 怎么申请
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
品牌SUNGO
公司SUNGO
流程SUNGO
国家欧洲
欧盟授权代表是您与欧洲当局的联系的桥梁,他们必须是在欧洲有实体存在。
2017 年5 月25 日,MDR 正式生效, 替代了原器械指令(MDD,93/42/EEC)和主动植入式器械指令(AIMD,90/385/EEC)。MDR 由指令升级为法规,提高了对欧盟成员国的约束力,具有直接约束性,*各国转化为本国的法律法规的形式即可落实实施。内容上,MDR 在整合原指令的基础上,大幅提升了有关器械认证的规范和限制,例如关于产品分类规则、器械的可追溯性、性能研究的规范、增加上市后的产品性和有效性的等方面。MDR 共10 章123 条,并附有17 个附录。

英国负责人UK Responsible Person 将设备投放到英国市场(英格兰,威尔士和苏格兰),英国的制造商必须在英国设立的英国负责人。下面单介绍了任命英国负责人将设备投放到北爱尔兰市场的要求。进口商和分销商*任命英国负责人。 制造商应计划在需要时尽快任命其英国负责人。然后,英国负责人必须根据上述宽限期,根据设备类别在MHRA中注册相关设备。 英国负责人代表英国以外的制造商行事,以执行与制造商义务有关的特定任务。这包括在将设备投入英国市场之前向MHRA注册制造商的设备。 英国负责人的职责在2002年英国MDR(经修订)中规定。总之,除了上述注册要求之外,英国负责人还必须: -确保起草了符合性声明和技术文档,并且在适用的情况下,确保制造商已经执行了适当的符合性评估程序 需要办理以下认证可以随时找我 : 1:出口欧盟:MDR CE认证/IVDRCE认证,欧盟授权代表,欧盟注册,欧盟自由销售证书 2:出口英国:英国代表,英国MHRA注册,UKCA认证,英国自由销售证书 3:出口美国:美国FDA注册,FDA510K,QSR820体系 4:中国:国内的器械注册证和生产许可证 5:出口加拿大:加拿大的MDEL注册 6:质量管理体系认证:ISO13485咨询和认证
类似于质量授权人注意到新法规主要在以下几点上发生了变化:1.器械的定义;2.器械的分类;3.基本和性能要求;4.技术文件要求;5.评价;6.上市后;7.Eudamed数据库;8.对NB公告机构的要求(新法规生效后NB将按照新的要求重新进行授权);9.对高风险器械的新增了要求;总的说来新的MDR和IVDR加强了体系管理,对高风险设备增加了相关规定比如对于非用途但具有与器械相似特性的设备也将受到新法规的管辖(如用于美容的彩色眼镜),提升了产品对患者的透明度和可追溯性并设立电子数据库(Eudamed)、设备将有一个的识别号这加强其在整个供应链的可追溯性。

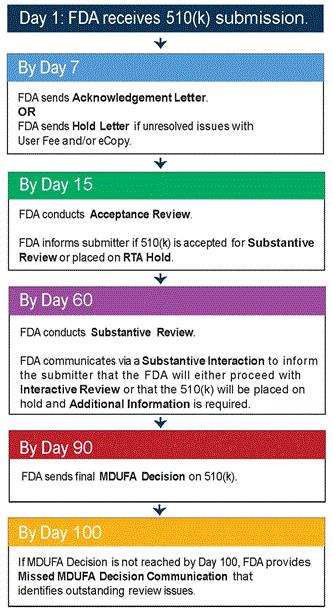
CE技术文件的编订,风险管理报告的编写,依据MEDDEV2.7.1Rev4编写的评估报告结论
SUNGO致力于为**的器械生产商和经营者提供市场准入的合规咨询以及国际注册服务。从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。
http://sungofda.cn.b2b168.com









