医用检查手套欧盟授权代表要求 UK REP是什么
更新时间:2024-11-17 浏览数:5
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
SUNGO始终追求支持、服务和客户满意。所有客户都有一对一的客服对接以保持经常性的联系,提供在线即时服务,针对贸易中存在的任何技术壁垒方面的问题提供的支持和解答。
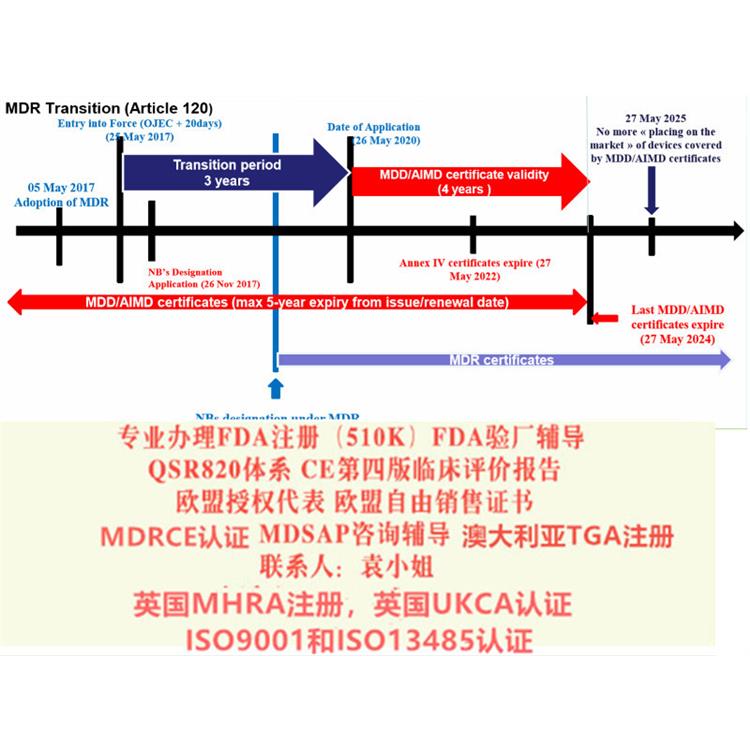
新的器械法规(2017/745 / EU)(MDR)和体外诊断器械法规(2017/746 / EU)(IVDR)使欧盟立法与技术进步,科学变革和进步在法律制定上保持一致。新法规将建立一个健全,透明,可持续的框架,得到国际认可,可提高性并为制造商创造公平的市场准入。与指令不同,法规不需要转变为法。器械法规(MDR)的背景MDR将取代现有的器械指令(93/42/EEC)(MDD)和主动植入式器械指令(90/385/EEC) (AIMDD)。

I类器械制造商应编制一份上市后报告,总结根据上市后计划收集的数据分析结果和结论,以及采取的任何预防和纠正措施的理由和说明。必要时应更新报告,并应主管机构的要求提供。

2017年5月5日,欧盟(Official Journal of the European Union)正式发布了欧盟器械法规(REGULATION (EU) 2017/745,简称“MDR”)。

CE认证策略咨询 协助您判定产品分类 协助您选择合理的符合性途径 协助您选则合适的公告机构 测试服务,或者向您的推荐合适的测试机构 根据我们的经验,为您制定认证的解决方案 协助您完成评估 为您编写CE技术文件 欧盟代表服务CE MDR认证中REGULATION (EU) 2017/745,简称“MDR”根据TUV莱茵消息,5月份以后将不再接MDD指令的CE订单,且现在接的订单企业必须在8月31日之前接受审核。由此可见,接下来将会是II类CE的一个申请高峰期,毕竟MDR的费用会比MDD高很多。
在此期间,仍然可以进行以下MDD证书的相关活动,例如产品变更及一年期内MDD新户的申请;现有MDD客户证书更新的相关活动;现有MDD客户证书更新的申请(包括提前更新的申请);现有MDD客户重大变更的申请期。虽然MDR的正式实施有延期,但是有例外情况如:
MDD产品的投放截止日期仍为2024年5月26日
MDD产品供应截止日期仍为2025年5月26日。
http://sungofda.cn.b2b168.com