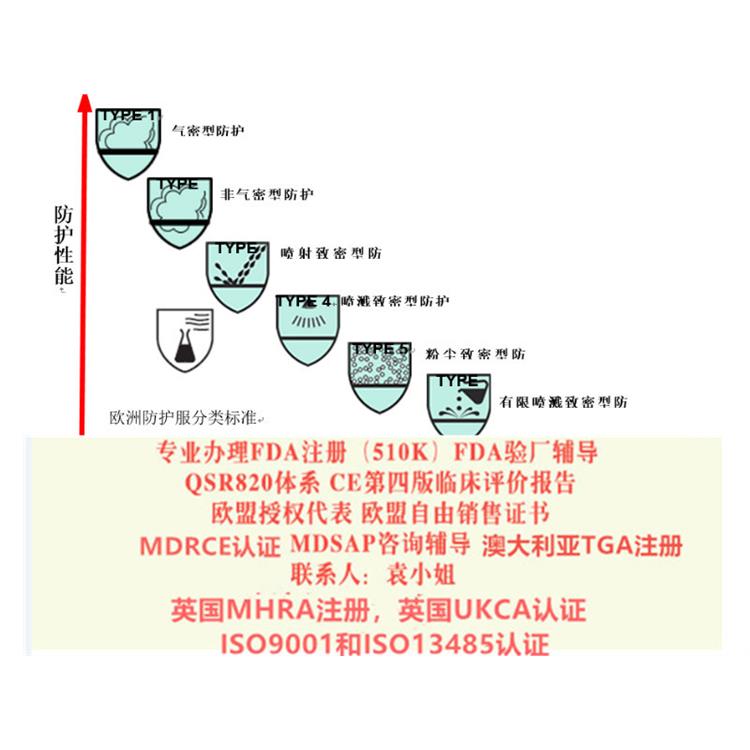
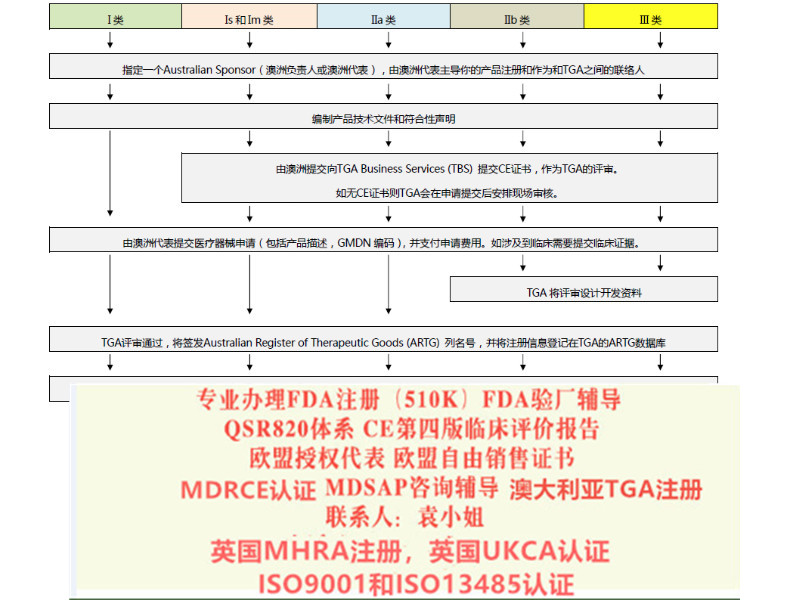
马桶椅的MDR CEMDR EU 2017-745认证 医疗器械法规MDR ga745 2017标准
更新时间:2024-11-10 浏览数:4
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
MDR还包括在互联网上销售器械以及用于远程提供诊断或服务的器械(第6条)。MDR为一些Ilb类器械和植入性Il类器械引入了由立小组进行的评估咨询程序(第54条)。
选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的战略伙伴。我们将秉承一贯“服务、客户”的原则,依托的技术团队,优化我们的服务,让更多的器械合法、进入市场,为器械行业健康发展贡献力量。
ASTM F2100检测报告 参考标准标准 ASTM F2100现行医用口罩材料性能标准规范Standard Specification for Performance of Materials Used in Medical Face Masks 检测项目及标准 1)过滤效率Bacterial filtration efficiency/ ASTM F2101 2)压差Differential Pressure/ EN 14683:2019 Annex C 3)颗粒过滤效率Sub-Micron Particulate Filtration/ ASTM F2299 4)合成血液穿透Resistance to Penetration by Synthetic Blood /ASTM F1862 5)阻燃Flammability/ 16 CFR Part 1610

关于Free sale certificate自由销售证书,器械办理自由销售证书有三种: 种:中国食品药品监督管理局出局的器械产品出口销售 (这种办理条件:企业必须是生产企业,有国内的产品注册证&备案证,生产企业许可证&备案证,齐全,企业直接联系局,递交资料可以申请,不需要费用) 第二种:也是需要有注册证和许可证,可以由品商会这些出局的自由销售证书 (这种一般泰国,越南这些,也认可商会这种自由销售证书) 周期是一个半月左右 第三种:对于企业是否有中国的器械注册证和生产许可证,并没有特别的要求的。 我们市场常见 英国,德国 美国 荷兰等等这些发达出的自由销售证书的,这种尤其是被沙特,埃及,阿根廷等 这种主要看产品,如果在欧盟风险等级属于I类的话,不需要国内局的任何,配合填写申请表,说明书,符合性声明即可 如果在欧盟的风险等级属于II类的话,不需要国内局的任何,但是必须要有公告机构的CE证书才可以办理。

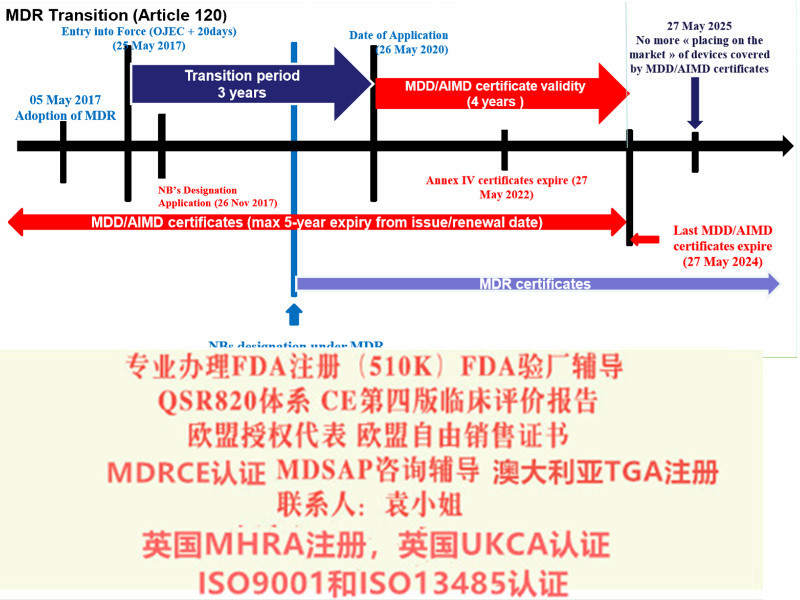
欧盟器械法规MDR (EU)2017/745第120条过渡性条款(Article 120 Transitional Provisions)应运而生。 MDD CE的持证制造商应符合Article 120条款要求,避免在宽限期严重不符合项的产生。 Article 120中需要关注的2个时间点: 1、2020年5月26日后,CE证书上的任何内容不再发生变化,已上市产品不能发生重大变更,如有变更,需要重新申请MDR证书。 2、2024年5月27日,MDD&AIMDD颁发的所有证书失效。 MDD CE的持证制造商需关注的两个方面: 1、基于MDD/AIMDD投放市场的产品,在2025年5月27日前可在市场上继续流通或投入使用。即若产品已进入市场且证书在有效期内,那么产品在市场上可以继续流通、使用,截至2025年5月27日。 2、2020年5月26日后,产品需满足MDR新规关于上市后监督、警戒、市场、经济营运商与产品注册的相关要求,以上要求对于企业至关重要,请听S君细细道来。 需要办理以下认证可以随时找我 : 1:出口欧盟:MDR CE认证/IVDRCE认证,欧盟授权代表,欧盟注册,欧盟自由销售证书 2:出口英国:英国代表,英国MHRA注册,UKCA认证,英国自由销售证书 3:出口美国:美国FDA注册,FDA510K,QSR820体系 4:中国:国内的器械注册证和生产许可证 5:出口加拿大:加拿大的MDEL注册 6:质量管理体系认证:ISO13485咨询和认证
我公司办理:出口欧盟的新MDR和IVDR的CE,欧盟授权代表,欧盟注册,BASCI UDI申报
http://sungofda.cn.b2b168.com