牙科垫的MDR-Class证书 欧盟MDR医疗器械CE认证 MDR技术文档对CE认证的重要性
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
法规条款增加,认证评审更加严格,MDR要求更高的透明度和可追溯性
SUNGO作为**化的器械法规技术服务商,可提供服务:
1. 确定您的器械在美国的具体分类及风险级别;
2. 企业准备510(k)申请所需的资料;
3. 确定检测标准及适用项目,推荐测试机构,对检测报告进行审查;
4. 编撰510(k)申报文件;
5. 企业进行小企业资质申请;
6. 跟踪510(k)文件评审进度;
7. 企业整改发补问题;
8. 进行企业注册和产品列名。
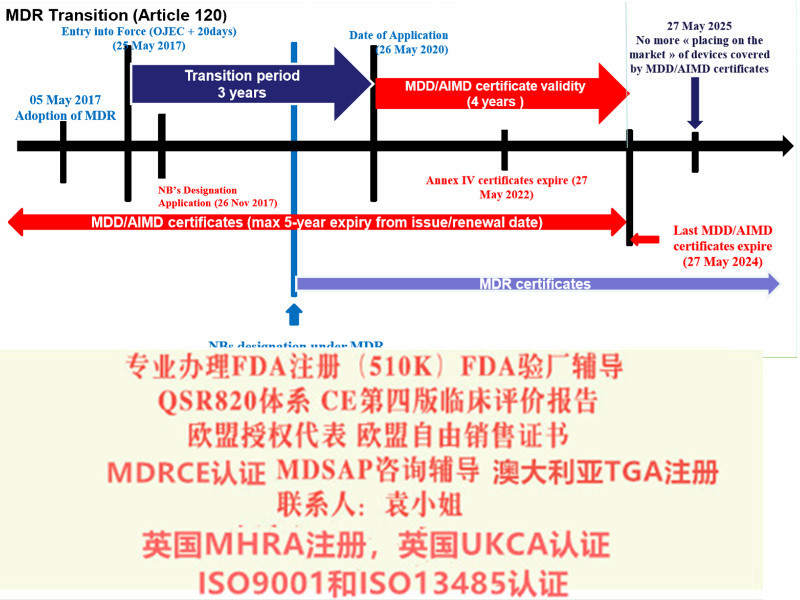
至2020年5月26日,MDR法规将强制实施。至2022年5月26日IVDR法规将强制实施。至2014年,MDD/ AIMD证书全部失效。MDR新法规变化1)扩大了应用范围2)提出了新的概念和器械的定义3)细化了器械的分类4)完善了器械的通用和性能要求5)加强对技术文件的要求6)加强器械上市后的7)完善评价相关要求事故对于患者意味着伤害,对于企业的生存也具有巨大的破坏力。因此,评估的设计和数据的收集具有至关重要的意义。然而在实践中,许多制造商不清楚什么是欧盟法规所要求的评估,什么样的数据能满足欧盟的法规要求。
谁必须要申请FDA510(k)
FD&C Act的第510(k)规章中并没有特别指出谁必须申请510(k)——任何人都可以申请。但是,他们了哪种行为,例如把器械引入美国市场,要求510(k)申请。基于的行为,必须向FDA递交510(k)的有:
(1) 把器械引入美国市场的生产商;
(2) 把器械引入美国市场的研发设计者;
(3) 改变器械或器械标签的再包装者;
(4) 把器械引入美国市场的外国厂家/出口商或外国厂家/出口商的美国代理方

主管机构应制定年度活动计划,并分配足够数量的胜任人力和物质资源以执行这些活动。
选择SUNGO,不是选择了一次性的合作伙伴 因为,所以放心!
http://sungofda.cn.b2b168.com









