产地上海
可售地**
品牌SUNGO
型号SUNGO BV
包装纸质
制造商的质量管理体系(QMS)和技术文件/设计文档由公告机构(Notified Body)审核和评估。若器械属于I类非、I类无测量功能或顾客定制产品,则不需要公告机构的介入。
该指南包括:明确评估意图、对评估各步骤的详细、明确等同性评估的条件、指出不可用于符合欧洲指令的数据的具体案例、关于评估报告更新的时间安排,对于评估人员的要求、以及此前版本指南不包括的其他具体细节。

技术文件的基本内容
器械说明与性能指标
包括变型和附件包含器械说明与性能指标,以及引用的前代和类似器械的信息。
制造商提供的信息
设计与制造信息
通用与性能要求
包含其符合附录I提供的通用与性能要求的资料。
风险利益分析和风险管理
产品验证与确认
前和数据(包含评价计划/报告,PMCF计划/报告);以及针对含药器械、人体/动物来源组织或其物制备的器械、引入人体并被吸收器械、具有测量功能器械等的相关附加信息
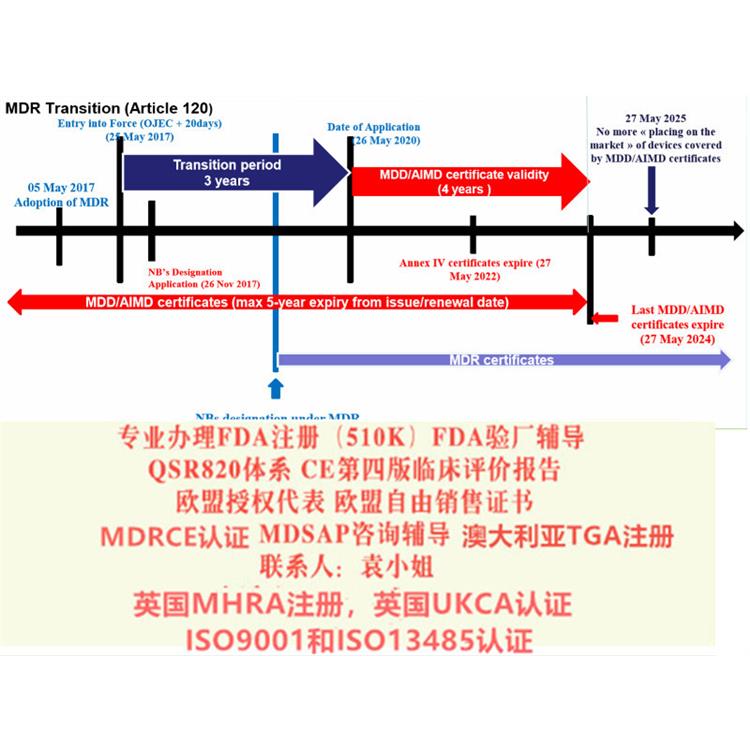
九、上市后的技术文件
AnnexIII TECHNICAL DOCUMENTATION ON POST-MARKET SURVEILLANCE 详细说明了要按照Article83-86 编写上市后的文件,包含上市后计划、上市后报告或定期性更新报告(PSUR)。
十、符合性声明文件
ANNEX IV EU DECLARATION OF CONFORMITY 详细说明了“符合性声明”文件包含的内容。
十一、加强器械上市后体系
Chapter VII POST-MARKET SURVEILLANCE, VIGILANCE AND MARKET SURVEILLANCE 着重说明上市后、警戒和市场。
建立、实施和维护上市后体系(见Article83)。
强调上市后体系贯穿整个生命周期,并不新。
建立“上市后计划”(见Article84),具体内容见Annex III。
I类器械编写“上市后报告”(见Article85)。
IIa、IIb和III类器械编制“定期性更新报告(PSUR)”(见Article86)。
PSUR需定期更新并作为技术文件的一部分。
建立警戒和上市后电子系统(见Article 92)。
在整个器械使用寿命期间,依据实施PMCF后取得的数据对评价及技术文件进行更新(Annex XIV part B)。

制造商的义务经销商,制造商,进口商等的义务及其关系现已在该条例中明确规定。第10条制造商应有风险管理制度(第2款)和质量管理制度(第9款);进行评估(第3段);编写技术文件(第4段);,并采用合格评定程序(第6段)。制造商亦须对其产品在市场上销售后负责(第12、13、14段)。它们必须有适当的制度来弥补它们对有缺陷的装置造成的损害所负的财务责任(第16段)。每个制造商应一名负责合规的人员(第15条)。一些可植入设备的制造商必须为患者提供植入卡(第18条)。一旦制造商完成所有这些义务,他们应制定一份符合性声明(第19条),并在其设备上应用CE标记(第20条)。欧盟/欧洲经济区以外的制造商应与欧盟/欧洲经济区内的授权代表签订合同(第11条)。授权代表(第11条)、进口商(第13条)和分销商(第14条)的义务也作了明确说明。公告机构NB根据MDR新规定,必须公告机构。器械将被要求满足更严格的标准,特别是在能力方面。

基于MDR法规要求升级ISO13485质量管理体系咨询服务
1) 企业现已有质量管理体系与MDR法规要求下管理体系差距评估;
2) 收集企业现有的文件资料:质量手册,程序文件,作业书,工艺文件,检验规程,记录等,并根据MDR
法规要求企业增加和修订相关体系文件;(依据认证机构的检查表要求,见附件);
3) 体系试运行检查(企业进行内审、管理评审);
4) 对体系运行效果进行跟踪评价并企业进行改进;
5) 针对开具的不符合项企业进行整改直至关闭(需企业配合);
SUNGO公司介绍:SUNGO创建于2006年。以助力大健康产品**流通为使命,我们致力于成为受用户信赖的合规服务机构。SUNGO的客户覆盖**洲,遍布30多个和地区,客户总数**过5000家。、、中国器械企业**过30%选择SUNGO,同时也有多家**器械企业选择SUNGO提供服务。
http://sungofda.cn.b2b168.com