周期4周
品牌SUNGO
公司SUNGO
流程SUNGO
国家欧洲
法规条款增加,认证评审更加严格, 引入了器械标识UDI,增加产品的可追溯性;
本指南为CE-器械指令应用问题相关的指南中的一部分,是关于评价资料撰写的一些原则,在MEDDEV 2.7.1 第三版的基础上增加了一部分内容,总体变更内容如下:
内容更多、更详细
提供更多有益的和案例
明确了现有要求,而非只是介绍
对于制造商应如何进行一个健全、系统的评价,以及如何数据和结论的科学有效性,有了更明确的
结合了欧盟器械法规(MDR),我们相信这将帮助器械制造商应对从指令到法规的过渡
PMS: Post Market Surveillance 上市后的监督
PMCF: Post Market Clinical evaluation 上市后的随访
4.CER明确、可衡量的目的
关于MEDDEV2.7.1 Rev 4,可以协助您:
1、协助建立评价程序;
2、建立评价方案
3、寻找等同产品,进行等同分析;
4、搜索文献及其他数据;
5、数据分析;
6、完成评价报告。

针对III类和可植入器械,提出了评估报告更新的频率;明确实质等同性需考虑的特点;要求其与风险管理的相互作用等等。申请MDR 技术文件需要资料 1.公司信息 2.产品信息 3.工艺流程 4.证 5.其它技术文件申请MDR 技术文件周期: 正常4周左右,如有节假日顺延,如有紧急,可申请MDR法规
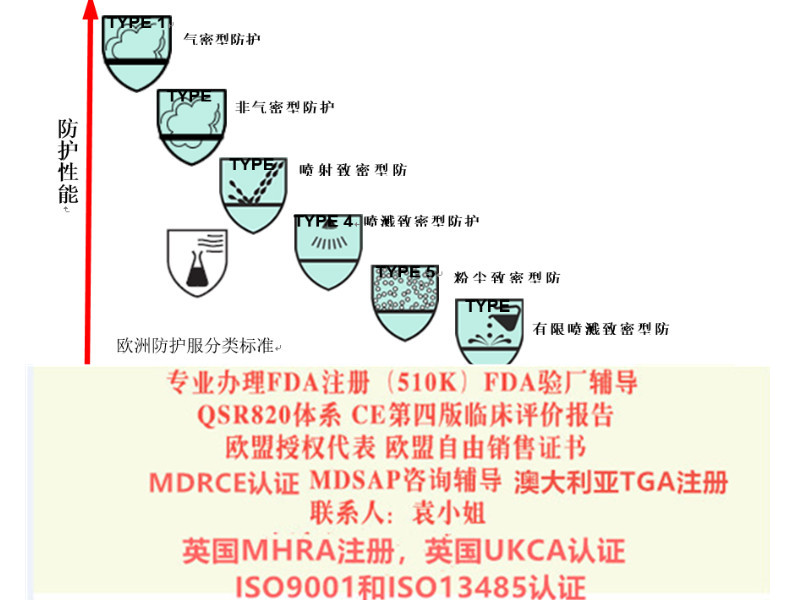
我公司办理产品出口欧盟、美国、中东南美等的各种认证:
TUV莱茵,TUV南德,***等CE认证,CE技术文件编订, CE第四版评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请), FDA QSR820验厂及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改,英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。2.7.1 REV4评价,CE的评价报告
关于CE认证的技术文件里第4版评价(MEDDEV 2.7.1 Rev 4)的背景:
MED 2_7_1 Rev 4的发布对评估报告提出了新的要求,所有打算申请CE认证或者已经取得CE认证需要继续维持证书有效的所有企业,都需要按照新版指南更新评估报告。2.7.1 REV4评价
新版指南的变化: 相对于之前的报告,第四版的报告主要变化体系在:
报告更新的频率
报告编写人和评价人的资质
评估报告需要有明确的可测量目标
确定技术发展水平
数据的科学性和有效性
比对器械
.比对器械的数据获得
什么时候需要试验
售后监督和售后跟踪
风险—收益。

基于本版法规的器械将很大程度上提高欧盟对器械产品的要求,不论是制造商还是公告机构都将面临更严格的管理,基于目前的产品分类规则,更多的产品将需要执行公告机构参与的符合性评估流程,更多的品种纳入了器械。
我们的核心资源包括分布在**主要经济体的运营网络,具有美国IAS认可资质的实验室,具有ANAB认可资质的认证机构,以及分布**的资源。
http://sungofda.cn.b2b168.com









