温州办理MDSAP证书 欢迎致电-需要什么材料
更新时间:2024-12-17 浏览数:196
所属行业:
咨询 管理咨询
发货地址:上海市金山区石化街道
产品数量:9999.00个
价格:面议
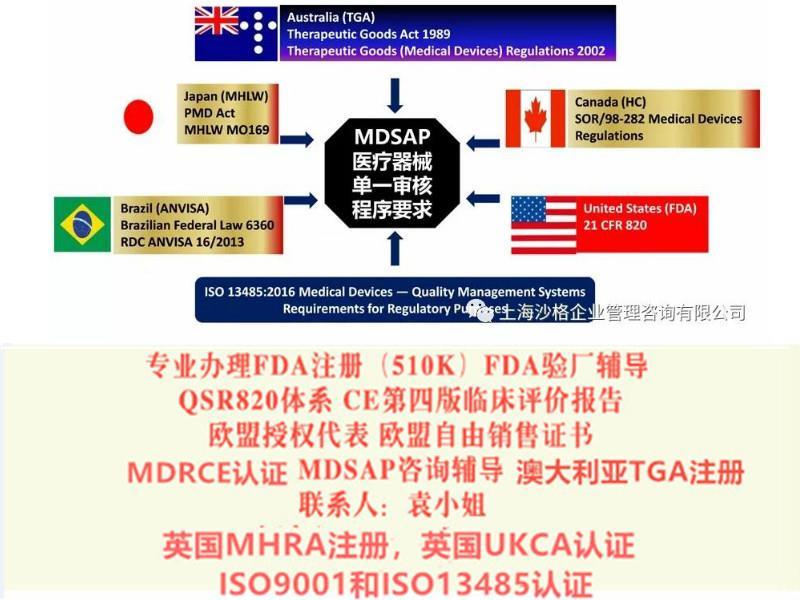
医疗器械单一体系审核MDSAP认证咨询辅导
1. ISO13485与MDSAP是什么关系
ISO13485是MDSAP的基础, MDSAP的要求要**/多于ISO13485的要求;ISO13485是标准,MDSAP除了ISO13485之外,还有各参与国的法规要求;
2. ISO13485&和MDSAP与风险管理的背景和趋势ISO13485要求
组织应对风险管理的一个或多个过程形成文件;美国21CFR820要求:设计开发确认中提到风险管理,但没有具体化;巴西RDC16要求:独立章节说明风险管理,但未对风险管理子过程与质量体系过程具体溶合进行说明;根据美国FDA及巴西ANVISA检查官审核的特点,后续则会将风险监视与CAPA相结合;
3. 产品设计与过程设计的关系
"将过程的设计开发纳入设计开发管理"在巴西RDC16法规中间接进行了要求;在13485:二003中同样进行了规定,但不完整.然而ISO13485:二016明确指出设计开发应包括过程的设计开发.过程确认的要求没有在过程控制环节提出,导致实际在企业运作中未能将过程设计开发的要求与产品设计开发过程溶合,这也是过程确认常被FDA开出警告信的原因所在;现在各国法规非常重视过程设计,一些具体的特殊过程标准已被开发,如灭菌,后续将会成为设计开发活动的*内容.企业在进行产品设计开发时需将过程设计当成设计开发任务的一部分。
4. 设计变更与设计开发持续合规
设计变更,包括过程变更,将可能会严重影响到成品器械的*和性能,这必然要涉及法规符合性的评估.实际在FDA审核过程中,必须评审或评价设计开发变更所引起的法规符合性问题,必要时重新启动符合性评定程序,如:补充注册或重新注册。已成为了一种不言而喻的要求,企业可以提前加入到内部质量体系控制中。
5. MDSAP能否完全替代参与国主管当局的审核
对MDSAP审核结果的认可,绝不意味着主管当局放弃其监管权力。
MDSAP实施的目的在于降低各参与国主管当局的监管成本,同时降低被监管企业的管理成本.在主管当局认为有必要时,仍然可以进行审核。相关的程度如下:美国:替代FDA的常规检查(FDA专项和PMA产品除外);巴西:对于三类和四类医疗器械,可以替代ANVISA的上市前GMP检查,以及上市后的例行检查(专项检查除外);日本:对于II类,III类,IV类医疗器械,可豁免现场工厂审核;加拿大:2019年起强制取代CMDCAS,作为分类在II类及以上产品进入加拿大的一途径;澳大利亚:可豁免TGA审核,支持颁发和保持TGA符合性审核证。
对于企业来说,如何保证器械的*有效,仍是组织始终关注的焦点。
SUNGO 致力于:
协助企业按照MDSAP建立医疗器械质量管理体系
协助企业在原有的质量管理体系上符合MDSAP的要求
整合企业的质量管理体系,满足各国法规的要求
提供MDSAP专项培训服务

MDSAP试点计划开始于2014年1月1,计划MDSAP项目于2019年1月1开始*实施。

MDSAP实施的目的在于,降低各参与国主管当局的监管成本,同时降低被监管企业的管理成本

-/gjhdff/-
http://sungofda.cn.b2b168.com