ISO13485&和MDSAP与风险管理的背景和趋势

国际器械监管机构:IMDRF取代GHTF,IMDRF国际器械监管机构管理会成员

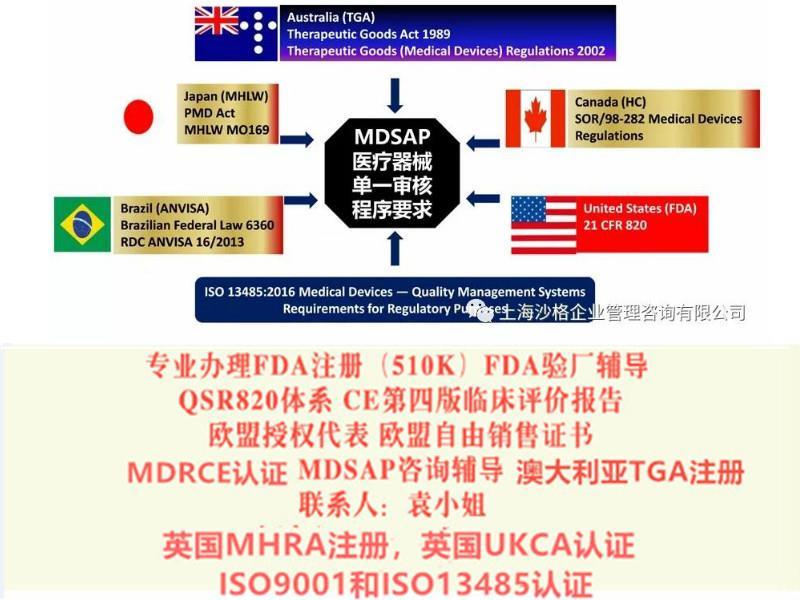
医疗器械单一体系审核MDSAP认证咨询辅导
医疗器械单一审核程序MDSAP(Medical Device Single Audit Program (MDSAP)是由国际医疗器械监管机构论坛(IMDRF)的成员共同发起的项目。旨在由具有资质的第三方审核机构,对医疗器械生产商进行一次审核即可满足参与国不同的QMS/GMP要求。
该项目已经获得五家监管机构美国食药品监督管理局 FDA,加拿大卫生局 Health Canada,澳大利亚**品管理局(中文简称)TGA,巴西卫生局 ANVISA 和日本厚生劳动省 MHLW 的认可,并且2019年1月1号正式实施MDSAP并对检查结果互认。目前,中国和欧盟以观察员的身份加入该项目,世界卫生组织也以观察员的身份正式加入。BSI已获该审核机构资质,正全力支持和推进MDSAP试点计划。
1. 国际医疗器械监管机构论坛:IMDRF取代GHTF,IMDRF国际医疗器械监管机构论坛管理**成员:US Food and Drug Administration (FDA)美国; Health Canada Medical Devices Bureau加拿大; Brazilian Health Surveillance Agency (ANVISA)巴西; Australia Therapeutic Goods Administration (TGA)澳大利亚; European Commission Directorate General Health and Consumers欧盟; Japan Pharmaceuticals and Medical Devices Agency (PMDA)日本; China Food and Drug Administration中国; Russian Ministry of Health俄罗斯.
2. 更多的MDSAP审核机构参照附件:Auditing Organization Availability to Conduct MDSAP Audits
以下是参与的五国监管机构就如何使用MDSAP报告的声明:
澳大利亚:医疗用品管理局(TGA)将使用MDSAP的审核报告作为评估符合医疗器械市场批准要求的部分证据 ,除非该医疗器械可以豁免上市批准要求,或者当前的法规不允许使用MDSAP的报告。
巴西:国家卫生监督局(ANVISA)将采用MDSAP审核结果以及审核报告作为产品上市前和上市后审核程序的重要输入,适当时,一些关键的信息还可以支持法规的技术评审。对于III 或IV类医疗器械,ANVISA可能使用MDSAP审核代替这些产品在巴西上市前的GMP审核。GMP是上市的必要条件,通过MDSAP审核可能会加速GMP认证过程。
加拿大:加拿大卫生部在3年的试点期间,同时认可MDSAP审核和加拿大医疗器械符合性评估系统(CMDCAS)审核。依据加拿大医疗器械法规第32章,MDSAP证或CMDCAS证都可被加拿大卫生部接受,用来申请新的(或维持现有)II,III或IV类医疗器械注册证。
美国:美国食品和药品管理局的器械和放射健康中心(FDA CDRH)将接受MDSAP审核报告替代FDA例行检查。FDA开展的“有因检查”或“合规跟进检查”不会受此计划影响。此外,MDSAP不适用于上市前批准(PMA)的器械所必须的上市前审核和上市后审核,以及法案(21 U.S.C.30c (f)(5))中513(f)(5) 章节下关于产品分类界定的器械。
日本:日本厚生劳动省 (MHLW)以及医药医疗器械管理局(PMDA)对在日本法规框架内的产品上市前和上市后的定期审核都将使用MDSAP的审核报告。
加拿大MDSAP:2019年起强制取代CMDCAS,作为分类在II类及以上产品进入加拿大的途径;
-/gjhdff/-
http://sungofda.cn.b2b168.com









