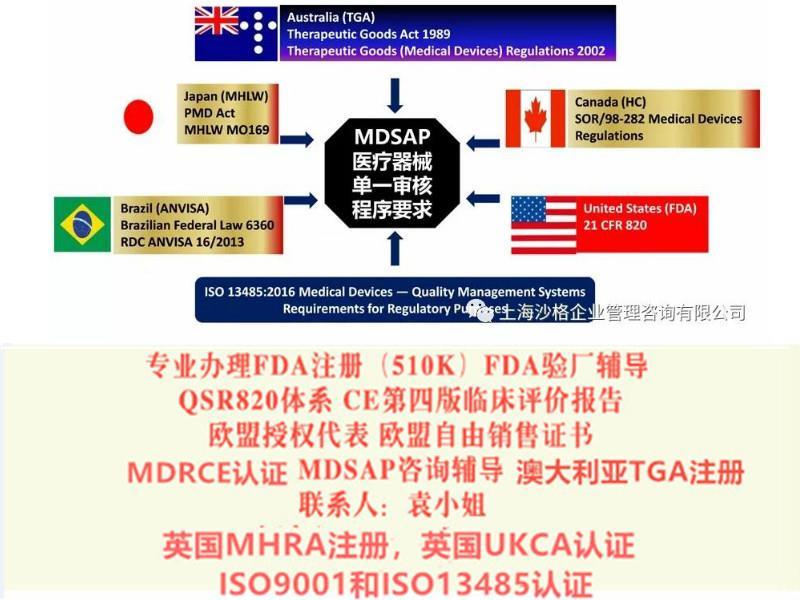
美国:MDSAP替代FDA的常规检查(FDA专项和P产品除外);

医疗器械单一体系审核MDSAP认证咨询辅导
● 医疗器械行业从业16年经验,医疗器械法规、体系咨询师
● 精通医疗器械CFDA,FDA,CE法规
● 熟练掌握ISO13485/YYT 0287, ISO14971/YYT 0316, QSR820, JGMP, GMP 质量体系等
● 擅长美国FDA QSR820医疗器械辅导,熟练掌握QSR820各难点子系统的要求
● 具有几十家医疗器械企业咨询辅导成功经验和案例,帮助企业*美国FDA QSR820的审核,并部分企业获得零缺陷通过;并辅导企业获得ISO13485证书及CE证书,CMDCAS证书等。主要辅导的企业包括:新华医疗,怡和嘉业,河北普康等
●对于美国法规有经验丰富的专业团队,能够及时高效的提供服务。目前我们是国内一一家成功提供了FDA警告信解除和黑名单移除辅导的咨询机构
一/ISO13485的升版会如何影响MDSAP?
以依据制造商的转换计划,来使用旧的或者新的ISO13485版本,审核模块已经更新已满足新版ISO13485的要求。
二、是否MDSAP审核会对于制造商增加新的要求?
此项目不会在ISO13485和参与项目的监管当局的国家的特定要求的基础上增加任何新的要求。
三、MDSAP审核程序简述:
初始认证审核是针对文件和整体准备情况进行审查,通常包括对规划文件的审查。
认证审核是针对与ISO13485以及参加MDSAP的监管机构的其他规定的QMS合规性进行评估。
监督审核每年进行一次,针对制造商的产品或QMS过程在初始认证审核之后的任何变化进行评定。
重新认证审核针对制造商的质量管理体系在满足MDSAP的QMS要求方面的持续适当性和有效性进行评估。
四、MDSAP审核程序的优势:
1、降低监管负担;
2、统一审核要求;
3、拓宽审核报告的认可范围;
4、降低整体审核时间和成本;
5、缩短结果响应时间;
6、扩大对第三方审核机构的选择;
7、提高监管机构的监管透明度和一致性。
我们的服务:
协助您按照MDSAP建立质量体系
协助您在原有的质量体系上符合MDSAP的要求
整合您的质量体系,满足各国法规的要求
培训服务
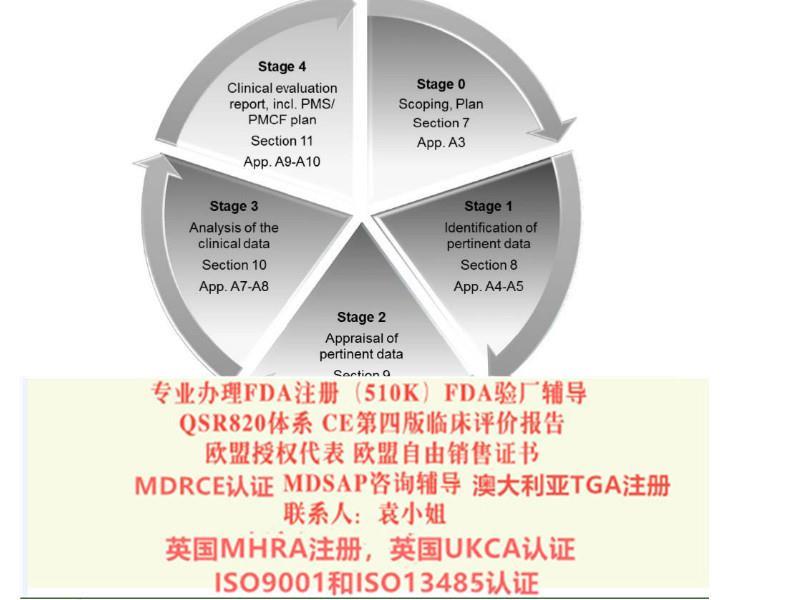
我们的服务:协助您按照MDSAP建立质量体系,协助您在原有的质量体系上符合MDSAP的要求

MDSAP审核代替这些产品在巴西上市前的GMP审核
-/gjhdff/-
http://sungofda.cn.b2b168.com