徐州办理MDSAP医疗器械单一体系审核-需要什么材料
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
加拿大在3年的试点期间, 同时认可MDSAP审核和加拿大器械符合性评估系统(CMDCAS)审核

日本厚生劳动省 (MHLW)以及医器械(PMDA)对在日本法规框架内的产品的定期审核使用MDSAP
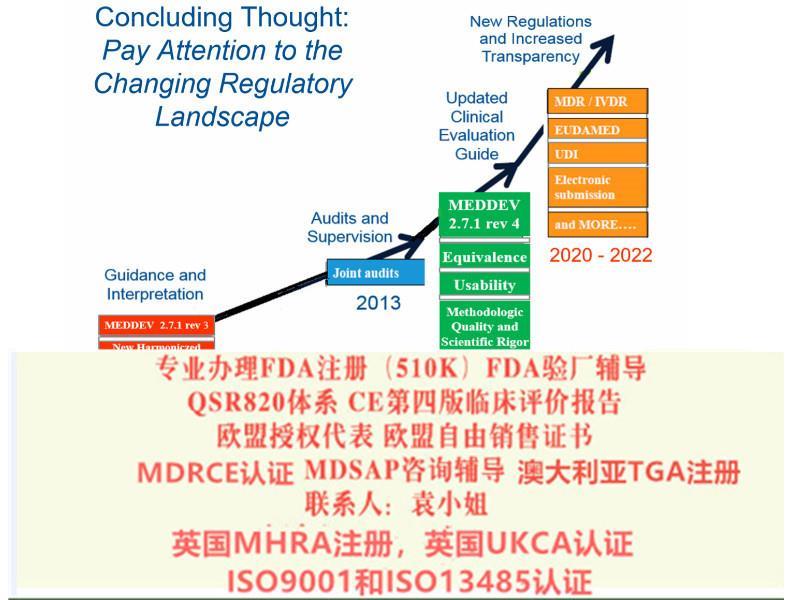
日本MDSAP:对于II类,III类,IV类器械,可豁免现场工厂审核;

医疗器械单一体系审核MDSAP认证咨询辅导
(1)WHAT
医疗器械单一审核程序”(Medical Device Single Audit Program (MDSAP) )项目是美国(FDA)、澳大利亚(TGA)、巴西(ANVISA)、加拿大(HC)、日本(MHLW)五国的监管机构认可并加入的一套新的审核程序。该程序旨在建立一套单一审核的过程,满足并统一上述国家的审核要求,使审核更加*有效。以上五国监管机构认可MDSAP的审核结果,生产企业可以减少对应不同监管机构的审核次数,减少因审核带来的生产干扰。MDSAP的出台,使审核过程国际标准化,减轻了生产企业的负担。ISO13485与MDSAP的对比:ISO13485是MDSAP的基础;MDSAP的要求要**/多于ISO13485的要求;ISO13485是标准,MDSAP除了ISO13485之外,还有各参与国的法规要求;两种认证,核心都是质量管理体系。
(2)WHY
根据加拿大卫生局已宣告的MDSAP过渡计划,CMDCAS证书(我司现有的ISO 13485证书)在2019年12月31日后将不被接受。为了继续持有现存的医疗器械许可证,制造商将在2019年1月1日前被要求提交有效的MDSAP质量管理体系证书。MDSAP加拿大过渡计划:加拿大卫生局打算将MDSAP实施列为制造商证明其符合质量管理体系要求的一途径。MDSAP于2019年1月1日开始实施过渡,过渡期两年。在这两年内,加拿大卫生局同时接受CMDCAS和MDSAP证书。2019年1月1日起,加拿大卫生局只接受MDSAP证书,CMDCAS质量管理体系证书需要被MDSAP质量管理体系证书替代。
(3)WHO
MDSAP由医疗器械生产企业联系第三方公告机构(如:***、BSI、TUV)进行审核,参与国(五国:美国、澳大利亚、巴西、加拿大、日本)的医疗器械监管部门可以将此审核报告作为判断依据。相关的程度如下:美国:替代FDA的常规检查(FDA专项和PMA产品除外);巴西:对于三类和四类医疗器械,可以替代ANVISA的上市前GMP检查,以及上市后的例行检查(专项检查除外);日本:对于II类,III类,IV类医疗器械,可豁免现场工厂审核;加拿大:2019年起强制取代CMDCAS,作为分类在II类及以上产品进入加拿大的一途径;澳大利亚:可豁免TGA审核,支持颁发和保持TGA符合性审核证书
(4)WHEN
按照加拿大过渡期计划,为了在强制日期(2019年1月1日)前取得MDSAP证书,考虑到公告机构的审核时限及证书审核和出具周期(约2个月),审核公司建议我司在2019年年初预约审核,建议在2019年6月之前完成现场审核。(注:公告机构约15天完成一个公司的现场审核及整改情况审核,沪X齿科和山东X鸽两个公司分开申请,合计30天)
(5)WHERE
由公告机构到企业进行现场审核。
(6)HOW
第一步,企业识别MDSAP法规,由质量管理部按照MDSAP的要求进行内审;第二步,由公告机构到企业进行现场审核;第三步,企业根据公告机构审核提出的整改项进行整改,15天内提交整改计划;第四步,公告机构审核企业的整改情况;第五步,审核通过,公告机构内部走*审批程序,颁发证书。
(7)HOW MUCH
审核公司决定终的报价,目前CTS综合几家在中国开展认证业务的公司预估的费用如下: a) 初次审核:(约11-19万) b) 年审:(约6.6-9万)。
http://sungofda.cn.b2b168.com









