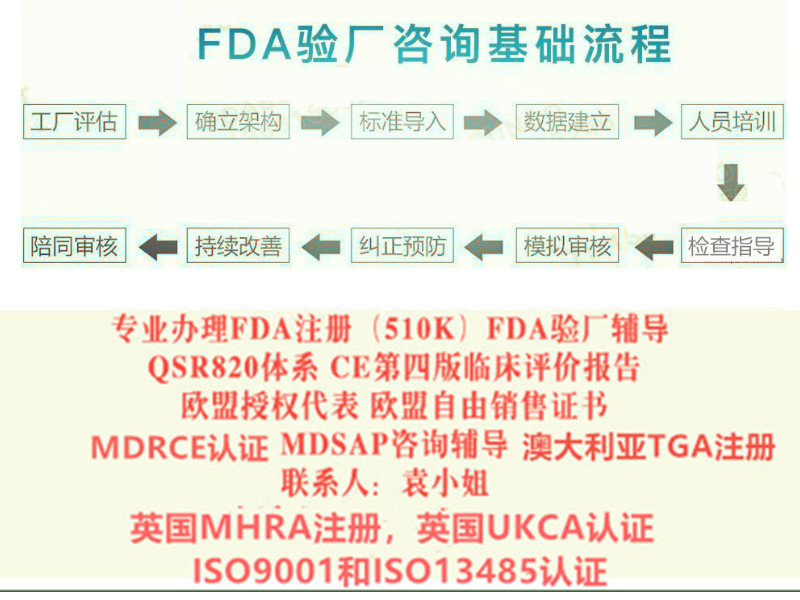
周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
SUNGO品牌创建于2006年,立志于成为**化的器械法规技术服务商。
如何选择欧盟授权代表EAR
EAR并非特定授予的资质或认可,没有第三方评价资质可以参考。任何一个能够履行欧盟法规特定职责的欧盟成员国境内自然人或法人都能够成为EAR。但EAR不仅仅是提供了一个欧洲境内的注册地和响应代表,合格的EAR还应当:
1)具有的法规和法律能力,帮助企业咨询、了解并响应欧盟法规;
2)合法高效的帮助制造商在欧盟境内注册相应设备和器械;
3)有充足的技术能力验证并评审企业技术文件,实施内部评审,降低质量风险;
4)具有一个良好的公共关系纽带,有丰富的经验帮助制造商与欧盟有关部门沟通并解决问题;
5)跟进法规更新,了解熟悉MDR,清晰识别EAR职责,有能力确保制造商符合较新要求。
出于节约成本的考虑,制造商自己的进口商或贸易律师等都可以是EAR的选择之一。为了更好地符合欧盟要求以及减少风险,也可选择专业的EAR代理机构。充分考察EAR的沟通能力、响应时效、信息准确性、规模和品牌、行业口碑等,是选择合格EAR的重要依据。
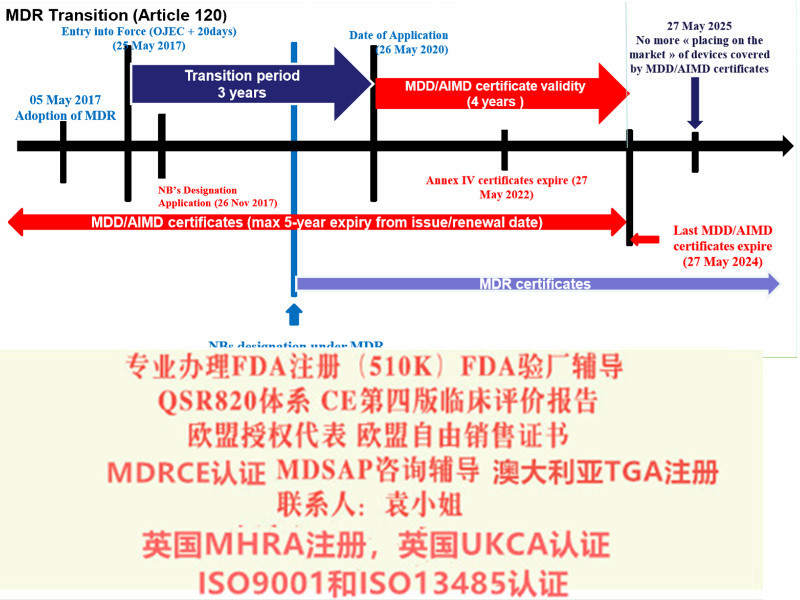
对制造商和产品的影响而言,93/42 EEC指令和MDR基本上具有相同的基本监管要求。没有现有的需求,但是MDR添加了新的需求,与目前93/42指令相比,MDR更加强调生命周期方法的*性,并有数据支持。MDR对公告机构的提出了更严格的要求,对国家主管当局和会加强了控制和监测。MDR对某些设备重新分类,范围更广。例如,MDR明确涵盖用于清洁、消毒或消毒其他设备的所有装置(第2.1条);一次性器械(第17条)};和某些无用途的装置(附件十六)。MDR还包括在互联网上销售器械以及用于远程提供诊断或服务的器械(第6条)。MDR为一些Ilb类器械和植入性Il类器械引入了由独立*小组进行的评估咨询程序(第条)。
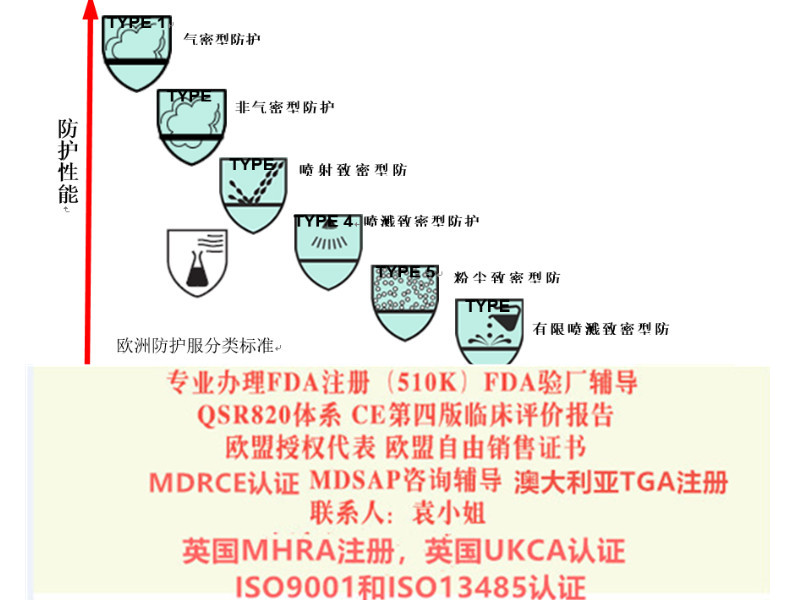
Class III,IV:
1. 通过CMDCAS认可的认证机构进行ISO 13485 审核认证(体系审核除ISO13485要求外还要包括CMDR的要求),获得证。
2. 准备Canadian Medical Device License (MDL)申请。
3. 提交MDL申请和Premarket review documents,并交纳行政收费。
4. Health Canada评审MDL申请和Premarket review documents, 评审通过后进行网站公示。
需要准备的文件清单
I类器械豁免注册。II,III,IV类器械的注册要求如下:
1. 通用注册资料:
a) 器械的名称;
b) 器械的分类
c) 器械的标识;
d) 产品标签上出现的制造者名称、;
e) 若制造地点与
f) 不同,则制造地名称、;
2. II 类器械注册附加资料:
a) 所制造、销售或代理的器械关于条件的目的及用途的描述;
b) 为满足*和有效性要求所符合的标准的清单;
c) 由制造者的高层主管作的*有效性符合声明;
d) 由制造者的高层主管作的器械标签符合加拿大器械法规的声明;
e) 若是近病人体外诊断设备(即不在而是在例如家庭使用的设备),制造者的高层主管应声明已用代表预期使用者的人体物质在与预期使用条件类似的条件下进行了研究性测试;

加拿大MDEL注册
根据加拿大器械法规(CMDR),按产品风险程度将器械分为 I, II, III和 IV四个等级, 风险等级逐次递增,I类器械为风险,IV类器械风险为。此针对制造者提出的产品注册要求也是逐级增加,要求制造者实行的体系是愈加详尽。
如果您计划进入加拿大市场,则需要进行产品注册登记以获得许可证,加拿大颁发器械机构许可证(MDEL)和器械许可证(MDL)两种不同类型证,并有不同要求
加拿大器械机构许可证(MDEL)
1. 什么是MDEL
MDEL是Medical Device Establishment License 的简称,即器械机构许可证。如果您准备在加拿大生产、进口或分销I类器械,您必须获得加拿大器械机构许可证(MDEL)。MDEL是对于机构的经营许可,无论器械属于哪个类别,器械经销商与进口商都必须获得MDEL许可证。
2. MDEL申请基本流程
(1) 企业为申请Medical Device Establishment License (MDEL)准备相应的文件,
(2) 提交MDEL申请,支付行政收费。
(3) 申请评审通过,将在Health Canada网站公示。
3. 下列几类情况能够豁免 :
(1)零售
(2)企业
(3)在加拿大市场销售企业名下获得器械产品注册证的II类III类和IV类的器械产品的制造厂商 (注:如果是市场销售其他企业名下获得器械产品注册证的II类III类和IV类的器械产品的制造厂商 ,也必须申请办理MDEL )
(4)I类器械产品的制造厂商,根据拥有器械产品营业许可证(MDEL)的企业在加拿大市场销售器械产品 ,则*申请办理MDEL
4. MDEL的有效期限
MDEL没有标明有效期限 ,但MDEL持有者一定要在每年4月1日前递交年度审核申请,MDEL才被视为继续有效,否则MDEL会被撤销 。
MDEL被撤销后,在加拿大的器械市场销售活动则也会被禁止。如果MDEL被撤销 ,MDEL持有者一定要再次申请办理并缴费,才能够再次获得MDEL,申请成功后,会发放一个新的MDEL许可证。
5. 申请MDEL需要完成申请表的如下内容,提交后2-4周可以获得证。
(1) 公司名称及联系方式
(2) 许可文件、邮寄和帐单
(3) 分类和活动表
(4) 场地
(5) 制造商信息
(6)
(7) 签名
选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的伙伴。
http://sungofda.cn.b2b168.com