周期4周
包装纸质
品牌SUNGO
是否进口否
可售卖地**
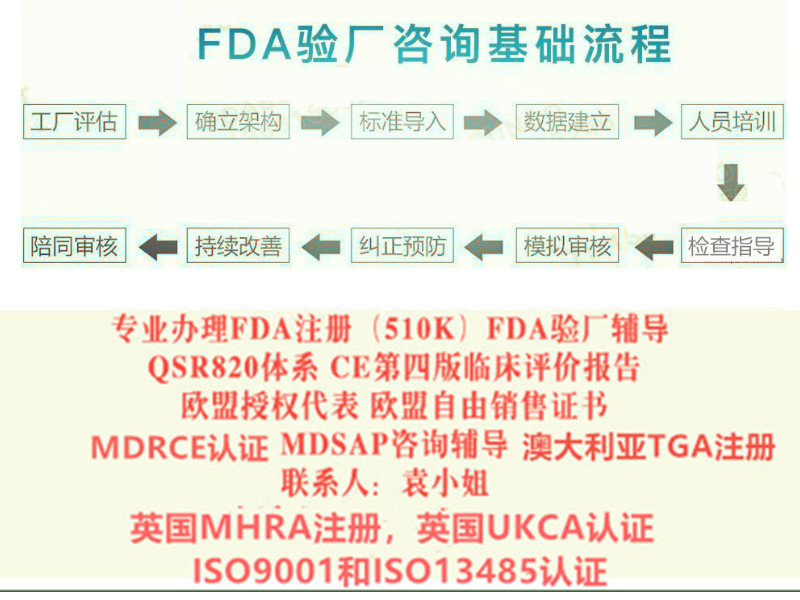
十多年里,SUNGO已为**30多家上市公司和****器械制造商,合计5000多家企业提供过相关服务。
3. III类器械注册的附加条件:
a) 器械及在其制造及包装中所用材料的描述;
b) 所制造、销售和代理的器械在其允许的条件、目的和用途下的性能描述;
c) 除加拿大外的器械获准销售的国家清单、售出数量,以及报导的问题及召回情况
d) 器械的设计和制造为满足*有效性而采用的标准清单;
e) 如果是以无菌出售的器械,则无菌方法描述;
f) 制造者为*有效而进行的研究描述,以及由此得出的结论;
g) 器械标签/复印件;
h) 如果为近病人体外诊断设备,用代表目的预期用户的人体物质,以在使用条件类似的条件下的研究测试的情况;
I) 所有与使用、*和有效有关的公开发布的报告的文献引用;
j) 由加拿大医疗器械认证机构认可的机构所颁发的CAN/CSA-ISO 13485:98
4. IV 类器械注册的附加条件:
a) 器械及制造和包装过程中所有材料的描述;
b) 所制造、销售或代理的器械所允许的条件、目的和用途的器械特性描述;
c) 除加拿大以外器械获准销售的国家,售出数量,以及报告器械的问题及召回情况;
d) 风险评估情况包括风险分析、风险评价,以及评价风险的满足*有效要求的措施;
e) 与器械相关的质量计划,如特定的质量实践,资源及行动的程序;
f) 制造和包装中使用的材料的参数;
g) 器械的制造过程;
h) 设计、制造中为满足*有效要求而采用的标准清单;
I) 制造者为证明满足*有效要求而进行的所有研究的详细情况,包括:
I) 前研究和研究;
ii) 过程验证研究;
iii) 适用时,软件验证研究,和
iv) 文献研究;
j) 若非体外诊断设备、取自动物组织或组织产物的器械,其客观生物*证据;
k) 若为近病人体外诊断设备,针对代表预期用户的人体物质且在相似使用条件下进行的研究测试的详细情况;
l) 制造者依据
I)款研究得出的结论;
m) 制造者依据
h)款研究的总述及由此得出的结论;
n) 与器械的使用、*和有效相关的公开发布报道的文献;
o) 器械标签的复印件;
p) 由加拿大医疗器械认证机构认可的机构所颁发的CAN/CSA-ISO 13485:98证。
器械许可证发布后,每年11月1日应由制造者向加拿大提出再确认。取消生产许可证应在停止加拿大销售的30日之内提出。

CE技术文件或设计文档(Class III)是相当于国内(中国)在产品上市前递交给局进行审评的注册文件,是对所涉及器械的一个综合*的的描述,旨在表明产品符合欧洲指令的要求。因此,编写产品
的技术文件或设计档案是欧洲CE认证过程中的非常关键的步骤,特别是在目前欧洲和公告机构对技术文档的监管和评估日益加严的背景下,制造商准备的CE技术文件的质量往往成为CE认证的核心和瓶颈。
技术文件或设计文档包括有关器械的设计、功能、组成、制造过程、使用、声称和评估的详细信息。它们是所有类别的设备(I类,I类无菌,I类测量,IIa,IIb和III类)所必需的,但是由于器械的种类和涉及的制造、评估过程的差异,没有两个文件是相同的。
根据多年的法规实践,峦灵建议将技术文件分为两部分:
A部分
(概要)
制造商信息:名称、、生产场地
产品名称、分类
公告机构的信息以及合格评估路径
符合性声明
产品基本介绍:预期用途、规格型号、附件等
标签、使用说明书及语言的要求
基本要求检查表
风险分析和控制的概述
产品符合的法规和标准
产品验证和确认的概述
评价报告
B部分 其余技术相关内容,如:
产品详细信息
基本要求的支持性证据
测试报告
数据
风险管理文档
过程确认
制造、检验的文件
应用的标

欧盟会规定了MDR 的转换期的要求
2017 年5 月25 日:MDR 和IVDR 生效
2020 年3 月25 日:启动欧盟器械数据库(Eudamed)
2020 年5 月25 日:MDR 实施开始
2022 年5 月25 日:IVDR 实施开始
2024 年5 月25 日:AIMD,MDD 和IVDD 证将失效

我们该怎么办?
l 重新确认产品风险分类等级,确认是否有风险等级升级的情况?
例如部分可重复使用的器械,原属于ClassⅠ的器械,按照新法规变成了ClassⅠ*类器械。美容类产品原MDD下不属于范围,现MDR法规中已纳入;
l 确认原CE证的发证机构是否已获得欧盟当局批准的颁发MDR证的,目前拥有该的认证机构:BSI、TUV南德(注意TUV莱茵目前还未获得批准);
l 确认原CE认证时的技术文件中是否含有按照Rev4原则提供的评价报告;
l 确定企业合规负责人(MDR法规要求),有相应能力、和经验来承担相应的法规工作职责。
l 修改原CE技术文件,建立质量管理体系,向具有MDR发证的认证机构提出MDR-CE认证申请,获得MDR法规下的新CE证。
目前SUNGO在中国、欧洲、北美和澳洲均设有服务机构,服务过的客户更是覆盖了(中国、越南、马来西亚、孟加拉、新加坡)、欧洲(英国、瑞士、瑞典、丹麦、挪威)、北美(美国、加拿大)、南美(阿根廷)、大洋洲(澳大利亚)和非洲(博茨瓦纳、南非)等国家和地区。
http://sungofda.cn.b2b168.com