周期8周
费用100000
资料基本资料
机构SUNGO
产品医疗用品
MDR新法规将建立一个健全,透明,可持续的框架,得到国际认可,可提高*性并为制造商创造公平的市场准入。与指令不同,法规不需要转变为国家法。
1.欧盟
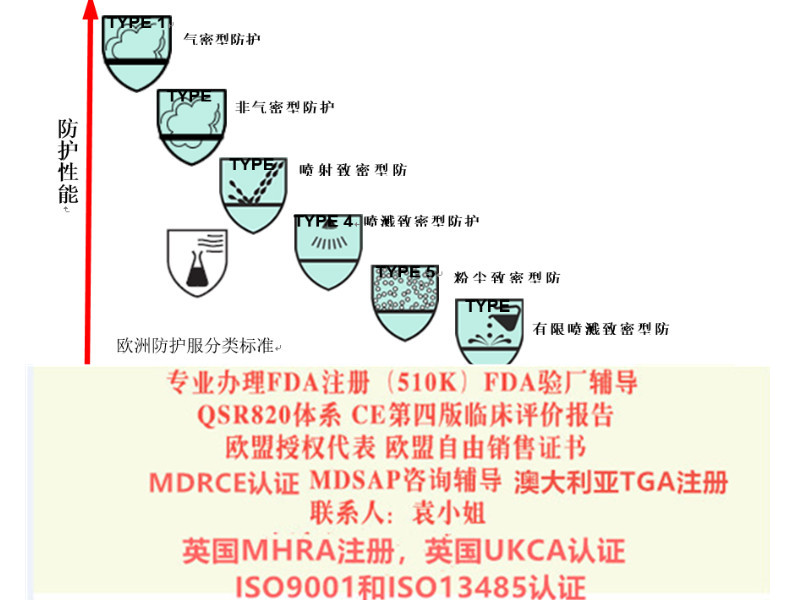
A.MDD/MDR在欧盟地区口罩等防护物资根据性能和用途不同既可以适用欧盟器械MDD指令或者MDR(2017/425)法规,也可以适用个人防护设备PPE(2016/425)法规。
1)非无菌I类器械:
无论按照MDD指令或者MDR法规,口罩、隔离服等产品均属于I类产品。如果产品是非无菌的,根据MDD或MDR要求,I类非无菌器械*公告机构介入。
I类非无菌产品出口欧盟要求:
1. 编制CE技术文档
2. 产品送检,取得产品检测报告
3. 出具自我符合性声明
4. 由欧代在其所在欧盟成员国主管当局(如CIBG、MHRA)进行信息注册并保存制造商的技术文档副件。
5. 在产品包装、标签上标记CE标志

1.欧盟(非无菌):医用口罩、面罩、眼罩、防护服、隔离服和手套等非灭菌I类产品与检测试剂盒产品,提供技术文件、欧盟授权代表和注册凭证证办理服务。
备注:欧盟对于I类的产品,要求企业自己必须确保自己的产品符合欧盟法规,产品是*有效的,并建立相关技术文件,签署符合性声明,确定欧盟授权代表,然后到成员国主管当局注册登记之后,即可在产品加贴CE标志进入欧盟销售。
不需要公告机构参与审核发证的
MDR的时间,尽快启动MDR法规合规准备事宜。
确认原CE认证时的技术文件中是否含有按照Rev4原则提供的评价报告;
l 确定企业合规负责人(MDR法规要求),有相应能力、和经验来承担相应的法规工作职责。
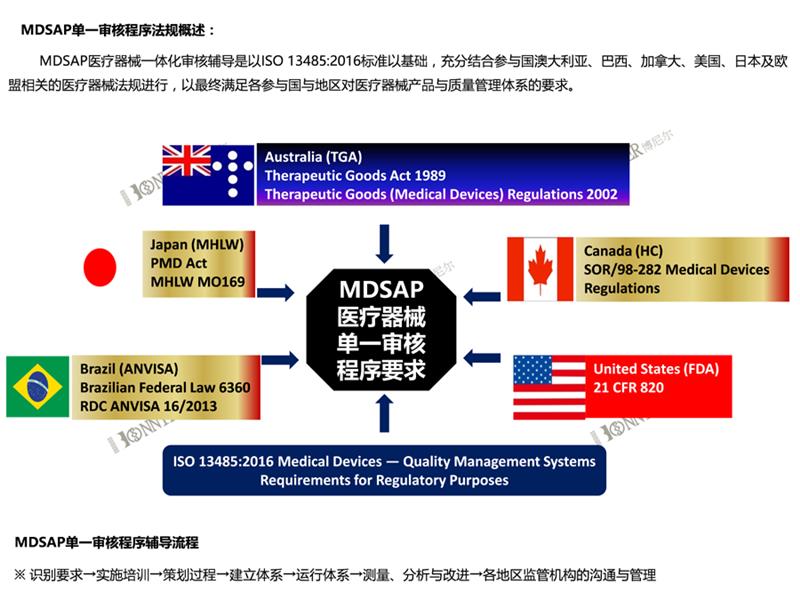
l 修改原CE技术文件,建立质量管理体系,向具有MDR发证的认证机构提出MDR-CE认证申请,获得MDR法规下的新CE证。

签订欧盟代表协议---起草I类器械的MDR CE技术文档---欧盟注册---
签发DOC。
这种途径符合CE的标志,就是完成如上四步,终生效的DOC是没有公
告号的。
建议企业同步建立ISO 13485器械质量体系,产品需要满足的检测
要求(比如口罩的EN14683产品性能检测;ISO 10993生物相容性检
测,还是要满足)。产品市场后的监督工作还是要有计划做。
另外,外销产品随附的文件,如说明书、标签都是要符合欧盟相关
器械标准要求EN ISO 15223 & EN 1041。
现在市面上所有发的设计精美,各式各样的所谓的发证机构发出的证
书,费用在1-2万,周期几天的,这种证,其实只是精装的DOC,如
果没有有效的欧代协议+TCF技术文档+欧盟注册作为支撑,这种证是
没有支撑证据的,也即没有真实的作用。
加强警戒和市场,一旦器械可以在市场上使用,制造商将必须收集有关其性能的数据,欧盟国家将在市场领域进行更密切的协调。
http://sungofda.cn.b2b168.com